首页 > 文秘写作 > 秘书基础 / 正文
穴位敏化动态过程的科学基础*
2023-05-04 20:05:13 ℃付红娟,齐文川,唐 勇,任彦蓉,刘雪莹,郑倩华,梁繁荣**
(1.成都中医药大学针灸推拿学院 成都 610075;
2.成都中医药大学附属医院针灸学校针灸推拿教研室 成都 610000)
穴位理论出自《黄帝内经》,是针灸学的重要组成部分。穴位在“分肉之间”、“骨空之中”,是经气聚会之所,为“脉气所发”,是疾病的反应点,可“知五脏之害”,又是针灸的施术部位,能“主治所及”,与脏腑功能密切相关。受《灵枢·经筋》“以痛为输”和《灵枢·背腧》“欲得而验之,按其处,应在中而痛解,乃其腧也”的启发,研究者们逐渐发现穴位是“活”的[1]。一是穴位功能是“活”的,“以痛为输”和“按之痛”表明穴位在正常生理情况下和异常病理状态下具有不同的功能表现。二是穴位大小是“活”的,疾病状态下内脏-体表汇聚神经元受到易化/敏化后,特定区域会出现体表感受野的扩大。即机体异常病变时,相应的体表特定区域发生痛觉异常等敏化现象,穴位的定位就是这些出现敏化现象部位的规律的总结。随着疾病的痊愈,敏化现象逐渐减弱甚至消失。说明穴位是从正常生理状态的“静息”态到异常病理状态下的“激活”态,是穴位反应疾病的基础。由此,学者们提出腧穴的本质是一种敏化态[2-3]。
穴位敏化是小刺激引起大效应的作用载体,是提高临床疗效的重要支点[2]。穴位敏化形式主要有电敏化、光敏化、热敏化、微循环敏化、痛敏化、声敏化等[4]。热敏和痛敏是穴位敏化最常见的两种表现形式,其中,热敏灸已发展成为一个成熟、有效、安全的中医特色外治技术,并在全国重点推广应用于临床。其特点是“小刺激大反应”,广泛应用于治疗20多种疾病,开创了一条治疗疾病的内源性热敏调控新途径[5]。最新研究认为,从肌筋膜激痛点活化状态的特征来看,它就是软组织病变部位敏化状态的“阿是”穴,是穴位痛敏化的一种形式,也是针灸对该病发挥最佳治疗效应的部位[6]。随机对照研究表明,针刺或热灸敏化穴治疗冠心病[7]、慢性颈痛[8]、压疮[9]以及膝骨关节炎[10]有良好的临床疗效。因此,继20世纪80年代经络研究“沉寂”后,“穴位敏化”成为这一针灸研究领域备受重视研究命题,对揭示针灸作用的科学原理具有重要意义。2015年国家自然科学基金重大项目“穴位的敏化研究”正式启动,随着项目课题的深入开展,目前已经积累了丰富的科学资料,这些资料对于构建当代知识背景下的现代针灸知识体系具有重要的学术价值。
基础研究表明,疾病状态下,相关的敏化穴位局部呈现出神经肽-肥大细胞-致敏物质释放的病理反应,并激活不同水平的中枢神经结构发生敏化[2]。然而,穴位敏化形成过程中,传递伤害性刺激信号的结构,神经肽-肥大细胞-致敏物质释放的先后顺序以及三者之间的相互作用关系,参与穴位敏化过程的中枢结构,以及是否存在非神经源性炎性物质介导穴位敏化的形成等问题尚不清楚。本研究总结了穴位敏化研究开展以来的研究成果,以期为未来穴位敏化的相关研究提供思路和借鉴。
机体在病理过程中通过神经源性牵涉反应诱发穴位产生感觉异变,反应了穴位的状态和功能强弱会随着机体的动态变化而改变,具有诊断及治疗内脏病变的双重作用,在生物学上具有重要意义。经过多年的动物实验研究和多中心、大样本临床研究,朱兵团队最新定义了穴位敏化的概念——指机体在病理状态下发生以神经源性炎性反应为主要特征、以“穴区敏化池”中的炎性介质为内源性调控启动因子的生物学程序[2,11]。穴位敏化的演变过程是动态的,此过程中涉及多种物质和机制,更是与“神经源性”、“炎性反应”、“神经系统”和“穴位局部”密切相关。了解参与穴位敏化发生的局部炎性物质和神经结构对于全面认识穴位的功能具有重要的意义。
2.1 C类伤害性感受器是传递信息和触发体表敏化区域炎性反应的关键神经元
众所周知,痛觉过敏是穴位敏化的最常表现形式。疼痛通常始于躯体或内脏结构中称为伤害性感受器的感觉受体的激活,伤害性感受器是位于皮肤、肌肉、关节和内脏的感觉终末器官,这些感受器会选择性地对有害或潜在的组织损伤刺激做出反应,并将伤害性(疼痛)信息传递给中枢神经系统。伤害性感受器被细分为无髓鞘C纤维和有髓A纤维伤害性感受器,其重要特征之一是它们具有敏感性(即它们的兴奋性可以增加)[12]。最近,Prato等[13]发现了一种C类沉默型伤害性感受器,它们在正常条件下对有害机械刺激不敏感,但在暴露于炎症介质神经生长因子中时会变得对此类刺激敏感。也就是说,这种C类沉默型伤害性感受器在疾病时能够被炎性物质“唤醒”,与穴位的敏化特性十分相近[14]。在一项观察传入神经末梢的分布与大鼠后肢中穴位相关性的研究中发现,无论是A类神经元还是C类神经元,神经感受野的分布都与穴位密切相关,并由此提出穴位可能是具有高密度神经末梢的可兴奋肌肉/皮肤-神经复合体[15]。最新研究中,马永圆[16]、Zhang等[17]通过逆向示踪和离体膜片钳方法记录支配犊鼻穴(ST35)的背根神经节(Dorsal root ganglion,DRG)中C类和Aδ神经元的动作电位,观察到在膝骨性关节炎(Knee osteoarthritis,KOA)后期大鼠ST35发生敏化后,双侧L5节段DRG中支配ST35穴位的C型神经元的兴奋性和产生的超极化电流(Hyperpolarization-activated current,Ih)密度增加,而对Aδ类神经元的活动无显著影响。同时,L5节段DRG中的环核苷酸门控阳离子通道亚型2(Hyperpolarization activated cyclic-nucleotide gated channel subtype 2,HCN2)蛋白表达水平升高,HCN2的上调主要来自C型神经元,运用ZD7288阻断HCN2通道后,ST35敏化受到抑制。由此,作者认为C型神经元的兴奋性增加和Ih/HCN2通道的上调是穴位敏化的形成机制。此外,最新研究发现,KOA大鼠敏化穴ST35局部瞬时感受器电位香草酸受体1(Transient receptor potential vanilloid,TRPV1)mRNA和DRG中p-TRPV1蛋白含量明显高于空白组大鼠,认为组织损伤时,炎症因子刺激激活TRPV1,引起Ca2+等阳离子内流,从而兴奋神经元,促进如SP、CGRP等神经肽的释放。SP、CGRP作用于肥大细胞,引起肥大细胞脱颗粒并释放5-HT、HA等致痛物质,形成“穴位敏化池”,导致穴位敏化[18]。因此,C类伤害性感受器是穴位敏化触发形成中的第一个关键物质。
2.2 SP和CGRP是调控外周神经致敏和肥大细胞脱颗粒的重要神经肽
如前所述,C类神经纤维与神经源性炎症反应介导的穴位敏化密切相关,C类沉默型伤害性感受器在接受冲动后从纤维末梢释放神经肽,包括SP物质和降钙素基因相关肽(CGRP)[19]。早在1978年,Hägermark等[20]已经发现SP是人体皮肤中一种作用于肥大细胞的有效组胺释放剂。随后的研究也表明,神经-肥大细胞在没有中间转导细胞的情况下也会发生交互作用,而神经肽物质如SP就是这种交流的重要介质[21]。因此,SP和CGRP在神经-肥大细胞的触发机制和交互作用中发挥的作用成为穴位敏化研究中的重要关注点。研究者发现急性胃黏膜损伤大鼠的“脾俞穴”和“胃俞穴”发生敏化,敏化穴位皮肤局部SP阳性纤维和蛋白高表达,同时伴有肥大细胞聚集和脱颗粒明显增多[22]。同样地,哮喘模型组大鼠的肺俞穴、定喘穴和华盖穴发生敏化现象,敏化穴位局部SP阳性目标平均光密度和MCs数目及其脱颗粒率显著增加[23]。在急性肠粘膜损伤模型大鼠和心肌缺血模型大鼠的敏化区皮肤中发现肥大细胞聚集的同时伴有CGRP的分布及蛋白表达量明显增加[24-25]。因此,神经肽SP和CGRP释放引起的肥大细胞脱颗粒改变的生物学过程是穴位敏化的生物学基础。但神经肽释放与肥大细胞脱颗粒之间的先后顺序以及神经肽物质刺激肥大细胞改变的机制和物质基础仍需进一步探索。
2.3 肥大细胞是导致敏化局部神经源性炎症反应的激发器,组胺、5-HT和类胰蛋白酶是构成局部“炎性汤”分子池的主要活性物质
肥大细胞(Mast cells,MCs)是参与外周神经源性炎性反应的主要炎性细胞,20世纪70年代,肥大细胞被发现与经络循经感传密切相关[26]。此后,肥大细胞在腧穴的研究中备受关注。石宏等[22]采用空腹稀盐酸灌胃造成急性胃黏膜损伤模型,发现模型大鼠“脾俞穴”和“胃俞穴”发生敏化,穴区局部肥大细胞出现聚集现象,其数量和脱颗粒率明显高于对照组以及穴区旁开组织。王巧侠等[27]发现KOA模型大鼠的鹤顶穴在造模7天时发生敏化,穴区皮肤和皮下组织中MCs数量和脱颗粒率高于对照组,且随疾病程度加重呈递增增长。秦萍萍等[28]运用软X线纳米CT成像在透射电镜观察到膝骨关节炎模型大鼠在造模14天和21天时阳陵泉穴呈现特征性的MCs脱颗粒改变:颗粒融合,胞外可见已脱出的颗粒或正在脱出的颗粒,胞内伴随颗粒密度降低,并出现遗留的空泡。研究者们用多种方法均发现穴位敏化局部的肥大细胞脱颗粒现象,由此认为肥大细胞在穴位跟随机体状态的动态变化过程中发挥着重要作用,肥大细胞可能是穴位敏化的细胞学基础和客观指标之一[29]。
在神经源性免疫炎症反应中,致敏的周围神经末梢释放血管活性肽、促炎性神经肽P物质(Substance P,SP)和降钙素相关基因肽(Calcitonin gene related peptide,CGRP),导致血管扩张、血浆外渗、白细胞浸润和肥大细胞活化[30]。肥大细胞激活后释放神经肽、组胺和其他致痛介质,刺激神经末梢释放更多神经肽,导致肥大细胞激活和外周神经致敏的恶性循环,进一步放大血管渗漏和神经源性炎症[31]。同时,释放的类胰蛋白酶、5-HT和组胺等物质对血管渗透性和白细胞迁移、粘附和运输具有直接影响,都参与了疼痛的外周机制。组胺通过其多种受体(H1R、H2R、H3R和H4R)在外周和中枢神经系统的神经源性炎症和疼痛传递中起关键作用,且组胺以双向方式与神经肽SP和CGRP相互作用[32]。类胰蛋白酶是肥大细胞颗粒的主要蛋白质,与神经末梢上的蛋白酶活性受体-2(Proteinase-activated receptor-2,PAR-2)相互作用[32],PAR-2可以激活TRPV1通道,刺激神经末梢释放神经肽SP和CGRP[33]。Ding等[34]以KOA大鼠为研究对象,在造模第14天时采用甲苯胺蓝和免疫荧光染色观察阳陵泉、鹤顶和委中穴位局部MCs的聚集、脱颗粒及MCs共表达介质类胰蛋白酶、5-HT和组胺的释放情况。结果显示KOA大鼠阳陵泉和鹤顶穴发生敏化,穴位局部MCs数量和脱颗粒明显升高,且与疾病严重程度正相关。敏化穴位局部胰蛋白酶、5-HT和组胺呈阳性表达。同样,He等[35]研究结果表明胃粘膜损伤模型大鼠敏化穴位局部皮肤过敏物质和伤害性神经肽SP、CGRP、HA、5-HT和类胰蛋白酶高表达可能是穴位致敏的潜在机制。综上所述,病理状态下,C类神经元向外周传递伤害性信息促使神经肽物质SP和CGRP释放,诱导肥大细胞脱颗粒释放炎性活性物质HA、5-HT和类胰蛋白酶和神经肽等致痛物质,此类物质以双向方式进一步刺激神经末梢释放更多神经肽,导致肥大细胞脱颗粒和炎性物质释放的恶性循环,最终形成“炎性汤”的分子池,导致穴位发生敏化。
1983年,Woolf[36]首次指出伴随外周组织损伤或炎症的疼痛超敏反应的许多特征是中枢神经系统感觉信号增强的直接结果,即中枢敏化现象。这种中枢敏化表现为阈值降低,对有害刺激的反应性增加和后遗效应延长(痛觉过敏),以及感受野扩大,使来自非损伤组织的输入产生疼痛(继发性痛觉过敏)[37]。穴位敏化最常表现为痛阈值降低,类似于内脏疾病的牵涉痛反应。如前所述,C类神经元与穴位敏化现象密切相关。研究者使用视觉引导的膜片钳技术在保留躯体和内脏神经的胸椎脊髓中记录脊髓I层神经元,发现体细胞和内脏C纤维单突触会聚到脊髓I层神经元上[38]。中枢敏化是否在穴位敏化中扮演角色引发了针灸学研究者们的关注。
朱兵团队率先采用电生理学方法,分别从脊髓背角、延髓和丘脑探讨敏化穴区的量-效关系及其相关的中枢机制[39-41]。该团队以结直肠扩张(Colorectal distension,CRD)作为内脏伤害性刺激观察是否发生穴位敏化效应。同时,分别记录“足三里-上巨虚”同侧L1-L3节段脊髓背角宽动态范围(Wide-dynamic range,WDR)神经元(又称为会聚神经元)、延髓背柱核(Dorsal column nuclei,DCN)、延髓背侧网状亚核(Subnucleus reticularis dorsalis,SRD)和丘脑腹后外侧核(Ventral posterolateral,VPL)神经元外周感受野的大小和放电情况,以及电针对CRD刺激前后神经元放电反应的影响。研究发现持续的内脏伤害性刺激可以引起穴位敏化效应,且随着CRD刺激强度的加大,以上四个核团神经元也呈现出一定的量效敏化关系。伤害性CRD刺激还可以加强WDR、DCN、SRD和VPL神经元对来自体表同节段穴位的电针传入产生更强烈的反应,引起穴位功能的敏化[39-41]。韩国学者Fan等[42]同样发现穴位的数量和大小随着内脏疼痛的严重程度而增加,即穴位敏化,这可能与脊髓背角WDR神经元的神经元反应增强有关。
最新研究表明,除WDR、DCN、SRD和VPL参与穴位敏化外,脑干迷走神经运动背核(Dorsal motor nucleus of vagus,DMV)在穴位敏化中的作用也引发关注[43]。研究者采用5% DSS溶液自由饮用建立结肠炎大鼠模型,发现大鼠体表敏化点主要分布于T12-S1节段,以L2和L5节段水平分布最为集中,上巨虚穴位发生敏化现象。结肠炎模型大鼠大鼠出现足底机械缩足反射阈值和热痛潜伏期降低,伴有脊髓背角浅层和DMV中乙酰胆碱转移酶阳性(Choline acetyl transferase,Ch AT+)神经元的激活数量多于正常组,认为脊髓背角浅层神经元和DMV中Ch AT+神经元参与了穴位敏化形成的中枢机制。
以上动物研究表明,中枢神经系统参与了内脏损伤诱导的穴位敏化过程。非内脏性损伤,如软组织疾病诱发的穴位敏化现象是否存在中枢敏化机制?研究者通过大鼠左膝关节内注射碘乙酸单钠建立KOA模型。根据撤足机械阈值、穴位肥大细胞总数和肥大细胞脱颗粒率检测穴位是否致敏。KOA大鼠双侧ST35穴发生敏化现象,同时伴有L3-L5双侧脊髓背角甘氨酸转运蛋白2(Glycine transporter 2,GlyT2)上调和细胞外甘氨酸水平的降低。选择性抑制GlyT2可减弱ST35敏化作用。椎管内GlyT2-shRNA注射可特异性下调同侧L3-L5脊髓背角GlyT2表达,阻断双侧犊鼻穴致敏作用。由此,研究者认为脊髓背角甘氨酸转运蛋白2表达升高是KOA大鼠ST35穴位致敏的重要介质,KOA大鼠ST35穴位敏化是由中枢敏化介导的[44]。
综上,内脏和软组织损伤的穴位敏化过程中,相应的中枢神经核团神经元呈现出一定的量效敏化关系,如脊髓背角、延髓背柱核、延髓背侧网状亚核、脑干迷走神经运动背核和丘脑腹后外侧核。以上核团神经元的异常活动可能是穴位敏化形成的中枢机制,抑制GlyT2转运蛋白可以阻断穴位敏化的发生。
目前,穴位敏化研究主要围绕神经源性炎症反应开展,集中于穴位敏化的外周和中枢机制。然而,随着科学技术进步和多学科交叉融合的推动,研究者尝试运用不同技术手段从不同研究角度探索穴位敏化的其他机制。
穴位是一个立体结构,其中,皮肤是发挥穴位效应的重要组成部分。由于皮肤微生态与内脏状态间存在相关性,皮肤局部的微生态可能是反应穴位状态和功能变化的“晴雨表”。既往研究发现细菌通过免疫或炎性信号通路造成疼痛,Chiu等[45]观察到金黄色葡萄球菌的α-细菌成孔毒素可直接在伤害性感受器上形成通道,也可以通过细菌N-甲醛化肽在伤害感受器神经元中诱导钙通量和动作电位,证明细菌可直接诱发疼痛。研究者认为穴位敏化中的疼痛症状可能与敏化穴位皮肤菌群的局部分泌相关。其课题组的研究初步发现,穴位敏化不影响细菌总体物种数量和分布,但在牵涉痛或“敏化穴位”处葡萄球菌属丰度明显增加[46]。因此,皮肤微生物可作为研究穴位敏化的新着力点,穴位敏化与皮肤微生态失衡的相关性有待进一步研究。
目前认为,内脏疾病状态时的神经源性炎症反应介导了内脏-体表牵涉痛(穴位敏化),是否存在非神经源性炎症介质诱导穴位敏化现象需要进一步探索。外泌体是常见的膜结合纳米囊泡,包含多种生物分子,如脂质、蛋白质和核酸。外泌体是由胞吐作用从细胞中衍生出来,被靶细胞摄取,可在局部或远处细胞之间传递生物信号,与穴位的内脏-体表相关存在相似性。Chen等[47]发现外泌体通过介导肥大细胞和神经之间的信息交换启动神经免疫调节过程,提出肥大细胞来源的外泌体调控针刺穴位的神经免疫调节是导致针刺疗效的关键因素之一。蒋一璐[48]对KOA大鼠足三里皮肤进行高通量测序,结果显示高敏组、低敏组和非敏组大鼠的足三里存在差异表达的miRNA,rno-miR-199a-3p、rno-miR-199a-5p、rnomiR-214-3p和rno-miR-205可能为KOA的“敏化miRNA”,这4条差异miRNA可能参与穴位敏化发生的调控机制。
基于以上发现,皮肤局部微生物、外泌体和遗传物质可能参与穴位敏化的动态过程,研究其在穴位敏化现象中的生物学机制有助于科学阐释穴位在内脏-体表相关中的作用,为针灸学发展和临床运用提供新的科学证据。
总结目前研究证据,穴位敏化动态过程中的三个关键点分别为脏器(内脏或关节软组织)-脊髓及脊髓上神经系统(中枢神经)-穴位(皮肤)。脏器损伤时产生伤害性信息传递至背根神经节细胞,分两种途径将信息传递至外周:一是将伤害性刺激信号顺向传入脊髓背角,通过中间神经元激活相邻的另一个背根神经节,以背根反射的形式将冲动逆传至外周;
二是在内脏传入伤害性刺激传入背根神经节细胞后,在分支处以轴突反射的形式逆向传出至外周。最终由C-类型伤害性感受器传出至外周的伤害性刺激促使神经末梢释放SP和CGRP等神经肽,进一步刺激肥大细胞聚集和脱颗粒,并释放类胰蛋白酶、组胺和5-HT等致痛物质,形成局部“炎性汤”的分子池,导致穴位出现敏化现象[2,11,22]。穴位敏化的形成过程中,脊髓上神经系统,如延髓背柱核、延髓背侧网状亚核、脑干迷走神经运动背核和丘脑腹后外侧中核神经元感受野增加,与敏化呈量效关系,抑制其中相应蛋白可以阻断穴位致敏作用。内脏损伤导致穴位敏化现象的物质基础如图1所示。
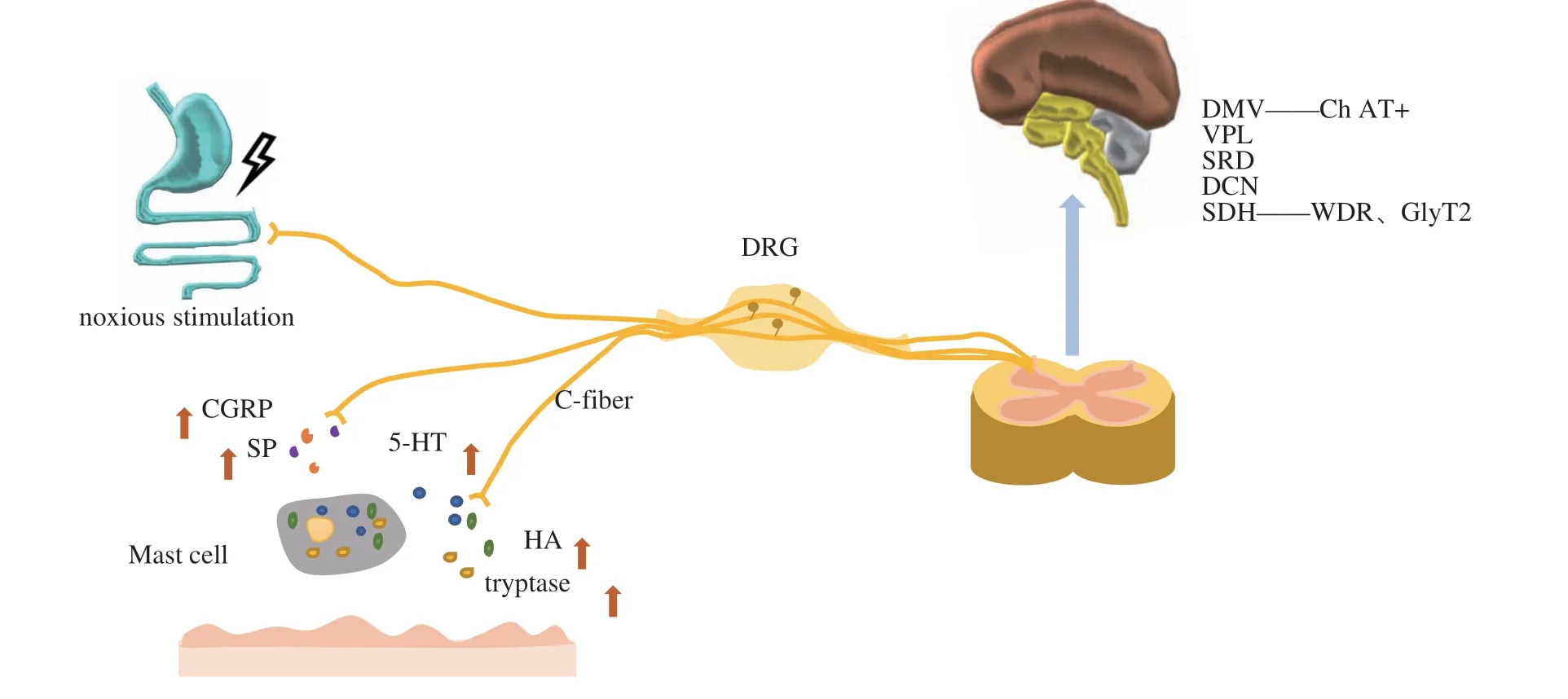
图1 参与穴位敏化形成过程的物质基础图
综上,穴位是动态变化的,会随机体功能状态的变化而改变,其过程称为穴位敏化。穴位敏化是感知和响应外界刺激的重要前提,是穴位功能增强的外在表象,是提高临床疗效的重要支点,有助于恢复因疾病而减弱的身体机能,可用于临床预后和疾病监测。穴位敏化的研究是针灸学领域原创性重大科学命题,对揭示针灸作用的科学原理、理论传承发展和进一步提高临床疗效具有重要意义。
据目前研究成果可知,穴位以神经源性炎症反应为重要特征,外周和中枢机制介导其发生过程。参与穴位敏化形成过程的伤害性感受器[14]、皮肤微生态[46]、肥大细胞[29,34]和中枢机制[11]分别得到阐明,而穴位敏化现象的完整过程尚不清晰。此外,与穴位敏化相关的最新研究成果在该过程中扮演的角色暂未得到阐述。本研究完整总结了穴位敏化动态过程中的刺激器(伤害性信号、神经肽及炎症物质)、传递者(C类伤害性感受器、肥大细胞)以及反应者(中枢结构及相关受体)。本文首次将最新发现的触发体表敏化区域炎性反应的关键神经元(C类伤害性感受器),DMV中Ch AT+神经元和脊髓背角中的GlyT2纳入穴位敏化形成的动态过程中,并以机制图的形式更加清晰的展示参与穴位敏化形成过程的物质基础。
回顾近十年研究成果,仍有许多关于穴位敏化的科学问题暂无答案。比如,肥大细胞是介导穴位敏化发生的关键细胞,目前研究仅聚焦于穴位或敏化点局部皮肤中肥大细胞在穴位敏化中的作用。然而,肥大细胞在全身分布广泛,目前已经发现中枢神经系统中的肥大细胞与多种疾病相关。那么,中枢系统中肥大细胞是否参与穴位敏化过程尚未可知。其次,有学者指出,穴位敏化的基础是局部肥大细胞聚集和脱颗粒,具有一定的“拟针灸”效应。在既往研究中,一些皮肤和神经病理疼痛疾病程度与肥大细胞激活呈正相关,不少研究提出以抑制肥大细胞激活为治疗靶点。以上两个观点貌似存在矛盾,两种反应是否启动不同的机制通路,或者发挥两种不同效应是否具备一定的转折点或平衡点也不清楚。最后,目前研究着力于穴位敏化的神经源性炎症反应的外周和中枢的神经机制研究。已经发现,肥大细胞可以通过外泌体与组织、器官之间进行信息交流,也有研究发现敏化穴位局部携带的RNA信息之间存在差异,是否存在不通过神经传递作用的其他信号通路介导穴位敏化的动态过程尚需进一步探索。未来的研究如能解答以上问题,相信穴位敏化动态过程的科学基础将更加清晰,也可为穴位敏化在临床诊治中发挥作用提供更多新的靶点,从而丰富穴位研究和临床应用的科学研究证据。
猜你喜欢 伤害性神经肽敏化 穴位敏化柔性辅助检测传感器的研发世界科学技术-中医药现代化(2022年2期)2022-05-25神经肽Y在心血管疾病中的研究进展医学综述(2022年5期)2022-04-20冠心病穴位敏化现象与规律探讨世界科学技术-中医药现代化(2021年8期)2021-12-21近5年敏化态与非敏化态关元穴临床主治规律的文献计量学分析世界科学技术-中医药现代化(2021年7期)2021-11-04棘皮动物神经肽结构与功能研究进展海洋科学(2021年6期)2021-08-02Cheap Shoots汉语世界(The World of Chinese)(2021年3期)2021-07-28CHEAP SHOOTS汉语世界(2021年3期)2021-06-18第十四章 地狱之城 ——核能小学科学(2021年1期)2021-04-26棘皮动物神经肽的研究进展❋中国海洋大学学报(自然科学版)(2021年4期)2021-03-02公民记者新闻报道特征及伦理问题研究传媒论坛(2020年9期)2020-09-06- 上一篇:电工基础教学计划,菁选3篇
- 下一篇:如何从零基础开始柔韧性训练(二)
猜你喜欢
- 2023-11-01 单位秘书个人工作总结6篇(精选文档)
- 2023-10-31 总经理秘书总结4篇
- 2023-10-24 最新关于教学秘书工作总结15篇
- 2023-10-23 2023年经理秘书年终个人总结8篇【通用文档】
- 2023-10-23 2023总裁秘书个人工作总结3篇【精选推荐】
- 2023-10-23 秘书年终总结8篇(完整文档)
- 2023-10-21 2023年度董事会秘书总结4篇
- 2023-10-20 2023年有关公司秘书上半年的个人工作总结9篇
- 2023-10-19 公司秘书的个人工作总结12篇(精选文档)
- 2023-10-15 学生会秘书部总结6篇
- 搜索
-
- 中国共产党建党时期第一批党员 09-04
- 践行初心使命心得体会10篇 06-29
- 党员自我批评简短150字 10-22
- 2篇2020年党支部书记述职报告 07-09
- 党史工作调研报告 08-31
- 国家开放大学电大专科《古代汉语(2) 10-31
- 村(社区)网格员职责和要求 05-03
- 组织生活会批评与自我批评意见 06-26
- 关于疫情的论文 07-17
- 公安民警2020年“政治建警”个人学习心得 10-14
- 11-25国庆70周年庆典晚会 庆典晚会串词
- 11-25办公室礼仪的十大原则 浅谈办公室的电话礼仪
- 01-17用心灵轻轻地歌唱_心灵的歌唱
- 01-17也许你不是我一生的唯一|也许不是我
- 01-17爱了,请珍惜;不爱,趁早放手|爱就珍惜不爱就放手
- 01-17岁月带走的是记忆,但回忆会越来越清晰|有趣又有深意的句子
- 01-17曾经的美好只是曾经,我只想珍惜身边的人|我只想珍惜你
- 01-18从容不惊 [学会笑眼去看世界,不惊不乍,淡定从容]
- 02-03当代大学生学习态度调查报告
- 02-03常用护患英语会话
- 标签列表
