首页 > 心得体会 > 学习材料 / 正文
樱桃枝干病害病原鉴定及生物防治
2023-01-14 19:15:06 ℃张淑静,赵 林,孙 超,王 静,马安宝,曲永赟
(1.山东省林业科学研究院,山东 济南 250014;
2.济南栖圣农林科技有限公司,山东 济南 250014)
近年来,樱桃作为一种重要的经济果树在全国果业生产中的重要地位越来越凸显,已成为我国乡村振兴、产业兴旺的重要引擎[1-4]。目前,全国樱桃的种植面积超过24.7 万hm2,年总产量在140 万t 左右[5-7]。樱桃栽培区域遍布全国23 个省市,樱桃已成为我国水果产业发展的重要组成部分。
然而,樱桃病虫害的发生已成为制约我国樱桃产业健康发展的主要障碍[8-9]。其中,樱桃枝干病害成为近年来樱桃树上一种毁灭性病害,发病严重地区直接导致樱桃树大面积枯萎死亡,造成樱桃绝收[10-11]。但目前对于樱桃枝干病害的病原及发病特征研究未有报道,同时如何有效采取针对性生物防治手段未见研究。为了明确樱桃枝干病害病因,我们对该病的病原进行了初步研究;
同时,筛选到高效拮抗该病原的生防微生物,并探究了该菌株液体制剂对樱桃枝干病害的防治效果,为后续针对樱桃枝干病害微生物菌剂的研发以及樱桃枝干病害生物防治提供理论和技术支持。
1.1 病害调查及采样
2019年至2020年连续2年在山东省主要樱桃产区烟台福山区、潍坊临朐县、泰安天宝镇以及淄博燕崖镇进行病害调查,调查面积超20 hm2。调查内容主要为枝干病害发生时间、发病症状、危害程度以及受害株率等。
同时,我们采集发生枝干病害的枝段,统一编号并标明采集地点和采集时间,送回实验室进行病原菌的分离等相关研究。
1.2 病原菌分离培养及鉴定
1.2.1 病原菌分离培养
将采集送回的枝段立即进行病原菌分离。先用蒸馏水将枝段清洗干净,再用75%乙醇溶液进行消毒;
再用无菌刀片和接种针在枝段病健交界处以及染病的木质部和韧皮部取组织块,接种于孟加拉红培养基上,在28℃条件下恒温培养。待培养物长出,在PDA 培养基上进行两次转板纯化。将所有纯化的培养物按照采集地点、采集时间和标本号进行统一编号,保存于4℃冰箱。
1.2.2 致病性接种试验
将活化好的yts-01、yts-02 接种于PDB 培养基中,28℃、120 r/min 培养72 h,经过滤将菌丝体除去,制成yts-01 和yts-02 的孢子悬液。选用健康的2年生樱桃树苗作为供试材料,一共30 株,分成3 组,分别做如下处理:在同一高度处用接种针进行扎孔处理:①在伤口处接种yts-01 孢子悬液;
②在伤口处接种yts-02 孢子悬液;
③在伤口处接种无菌水作为对照。选择的樱桃树有一定的间隔,防止试验过程交叉感染。每隔5 d 观察发病状况。
1.2.3 病原菌形态特征观察
将活化好的病原菌接种于PDA 培养基上,进行形态特征观察,主要包括菌落形态、生长速度、颜色等;
制作切片在显微镜下对其分生孢子形态、大小等特征进行观察。
1.2.4 病原菌分子生物学鉴定
将分离后获得的病原菌纯培养体送至山东森琪生物技术有限公司进行ITS 序列测序。将测的序列在在线GenBank 核酸数据库中进行Blast 分析,得到相关性序列,利用MEGA7 软件构建yts-01 系统进化树,并进行yts-01 系统发育分析。
1.3 荧光假单胞杆菌GH2-1 对樱桃枝干病害病原的抑制作用
1.3.1 樱桃枝干病害病原高效拮抗菌株筛选
利用平板对峙培养法,对高效拮抗樱桃枝干病害病原越橘间座壳(Diaporthe vaccinii)的拮抗菌株进行筛选。
将实验室已保存的14 株待测拮抗菌株于NA 培养基上划线培养,28℃恒温培养24 h;
用接种环挑取一环菌苔接种于含10 mL NB 培养基的50 mL 三角瓶中,于28℃摇床中120 r/min 均匀震荡36 h,得到待选菌株的活化菌液。将越橘间座壳于PDA 培养基上进行活化培养,28℃恒温培养60 h。用打孔器在活化好的樱桃枝干病害菌边缘打取直径为5 mm 的菌饼,接种在PDA 平板中央;
在距中央2.0 cm 的两侧用移液枪接10 μL 待选菌液;
对照组在另外两侧相同距离处接种10 μL NB 培养基。每一处理重复3 次。处理完成后,28℃恒温培养,逐日观察待选菌株对越橘间座壳的抑制作用;
待对照组病原菌长满平板后,测量实验组病斑的大小,并计算抑菌率。
抑菌率=[(对照菌落直径-菌饼直径)-(处理菌落直径-菌饼直径)]/(对照菌落直径-菌饼直径)×100%。
1.3.2 荧光假单胞杆菌GH2-1、发酵上清液及所产挥发性物质对樱桃枝干病害病原的抑制效果
采用平板对峙法检测荧光假单胞杆菌GH2-1 对樱桃枝干病害病原生长的抑制效果。实验方法同1.3.1。
采用含毒介质法检测荧光假单胞杆菌GH2-1 发酵上清液对樱桃枝干病害病原生长的抑制效果。将荧光假单胞杆菌GH2-1 发酵上清液与PDA 固体培养基按照1:10 的比例充分混合,制成含毒平板;
将樱桃枝干病害病原菌饼接种于平板中央,对照用无菌水代替,每个处理重复3 次。后续实验同上。
采用倒扣平板法检测荧光假单胞杆菌GH2-1 所产挥发性物质对樱桃枝干病害病原生长的抑制效果。对照组:将樱桃枝干病害病原的菌饼接于PDA 平板中央并倒扣于LB 固体平板上,封口。实验组:吸取100 μL荧光假单胞杆菌GH2-1 菌液于PDA 平板上,用灭菌的涂布棒均匀涂开,于28℃培养箱中培养24 h。将樱桃枝干病害病原菌饼接于PDA 平板中央并倒扣于荧光假单胞杆菌GH2-1 平板上,封口,于28℃培养箱中培养。每一处理重复3 次。后续实验同上。
1.4 荧光假单胞菌GH2-1 液体制剂对樱桃枝干病害防治效果
1.4.1 供试药剂
GH2-1 液体制剂300 倍稀释液。
1.4.2 供试材料与防治对象
供试材料为樱桃幼苗,品种为 ‘红宝石’;
防治对象为樱桃枝干病害,病原越橘间座壳(Diaporthe vaccinii)。
1.4.3 试验地情况
试验地设在潍坊市临朐县樱桃产区。往年樱桃枝干病害在该地发病严重,特别是樱桃苗移栽后因感染樱桃枝干病害成活率较低;
我们于2020年3月15日、3月31日和4月15日进行林间防治樱桃枝干病害试验。所有试验小区栽培条件及管理措施一致,施药时樱桃枝干病害处于发病初期。
1.4.4 试验设计及安排
本试验设计了荧光假单胞菌GH2-1 液体制剂300 倍稀释液和不施药清水做对照共2 个处理,每个小区200 m2,重复3 次,共6 个小区,各小区随机排列。共施药2 次,第1 次于2020年3月15日进行浸根处理;
移栽缓苗15 d 后于2020年3月31日第2 次施药,本次方式为灌根,每一小区施用量100 kg;
4月15 第3 次
施药,本次方式为喷雾,每一小区施用量15 kg;
5月中旬进行发病情况调查。
1.4.5 试验调查及计算方法
最后1 次用药间隔30 d 后统计发病状况,并计算防治效果。
樱桃枝干病害发病级数参照表1,以单株为单位。

表1 樱桃枝干病害发病分级标准Table 1 Classification standard of cherry stem disease
药效按式①、②计算:
病情指数DI(%)=[∑(病级数)×该级发病植株数)]/[(病级最高值×调查总株数)]×100%①
防治效果(%)=(对照病级指数-处理病情指数)/对照病情指数×100%②
2.1 樱桃枝干病调查结果
2.1.1 樱桃枝干病危害情况
在连续2年的调查中发现,樱桃枝干病害在3年以内树龄的幼林中发病严重,特别是对刚移栽的樱桃幼苗危害尤为严重;
4月进入发病高峰。通过实地调查发现,在调查的全部幼林中,发病严重地区占40%左右,此病区樱桃感病率高达80%以上,死株率约50%以上,特别严重的几乎全部死亡。
2.1.2 樱桃枝干病病症特征
樱桃枝干病发病后,树干表面有明显内陷区域,明显感到树皮与树干分离;
但初发病源颜色变化不明显;
进一步观察发现,病原侵染后,发病部位由木质部向韧皮部扩展逐渐变黑腐烂,也可由韧皮部向木质部扩展变黑腐烂,还表现在由近根处向远根处进行扩展,最终导致主杆或侧枝干枯(图1)。
为了进一步确定樱桃枝干枯死是由病原菌感染所致,我们将部分样品喷洒无菌水保湿,3 天后发现在枝段横切木质部有大量真菌生长(图2)。

图2 感病枝段木质部真菌生长状况Figure 2 Growth status of xylem fungi in susceptible branches
2.2 病原菌分离培养及鉴定
2.2.1 病原菌分离培养
利用真菌分离技术将采集送回的142 个枝段样品进行病原菌分离纯化,共分离314 株真菌。经平板培养发现,所有分离菌株分为两种菌落形态,其中289 株菌落形态一致,编号为yts-01;
剩余25 株菌落形态一致,编号为yts-02。由此,我们初步推测yts-01 为樱桃枝干病害的病原菌。
2.2.2 致病性接种试验
由于致病性接种试验期间温度和湿度处于发病最佳条件,在处理10 d 后即可观察到接种部位发生变化。结果显示,接种yts-01 孢子悬浮液的樱桃全部发病,在接种处出现褐色病斑且该区域明显内陷;
接种yts-02 和无菌水的樱桃均不发病。
对发病的部位取样进行病原菌的分离培养,发现分离到的菌株菌落形态与试验菌株yts-01一致,符合柯赫氏法则。以上结果证实yts-01 为樱桃枝干病害的病原菌。
2.2.3 病原菌形态特征观察
接种在PDA 培养基上的yts-01 菌落生长速度快,平均生长速度为1.5 cm/d,6 d 左右基本长满平板(图3-A)。菌落初期为白色、圆形,气生菌丝疏松不紧密,随着生长,出现不规则同心圆(图3-A)。后期,在同心圆上生长出子座(生长第6 d开始出现),且菌落表面变灰色(图3-B,图3-C)。

图3 yts-01 菌落培养特征Figure 3 Colony culture characteristics of yts-01
分生孢子梗较短或分化不明显,分生孢子串生于分生孢子梗上,呈现圆形、椭圆、长圆柱等形状,长度5~7 μm(图4)。

图4 yts-01 分生孢子Figure Conidia of yts-01
2.2.4 病原菌分子生物学鉴定
我们将测序结果与GenBank 中收录的DNA 序列进行比对,并建立yts-01 进化树。结果说明,樱桃枝干病病原菌yts-01 与Diaporthe vaccinii(Accession No.LC206678)聚成一支,同源性最高(图5)。

图5 yts-01 系统发育树Figure 5 Phylogenetic tree of yts-01
因此,综合菌株的ITS 序列分析与形态学特征,鉴定yts-01 为越橘间座壳(Diaporthe vaccinii)。
2.3 荧光假单胞杆菌GH2-1 对樱桃枝干病害病原的抑制作用
2.3.1 樱桃枝干病害病原高效拮抗菌株筛选
结果显示,在实验例1 中分离到的14 株菌中,有6 株菌对樱桃枝干病害菌生长有抑制效果,分别为GH2-1、GH2-2、GH2-4、GH2-5、GH2-6 和GH2-9(表2);
通过对不同菌株抑菌率计算统计发现,菌株GH2-1 对樱桃枝干病害菌抑制效果高达90.98%,显著高于其他菌株(表2)。

表2 不同菌株抑菌率统计Table 2 Statistics of bacteriostasis rate of different strains
前期,我们已鉴定GH2-1 为荧光假单胞菌,故结合上述抑菌率结果,选择荧光假单胞菌GH2-1 为研究对象进行后续相关研究。
2.3.2 荧光假单胞杆菌GH2-1、发酵上清液及所产挥发性物质对樱桃枝干病害病原的抑制效果
从图6可以看出,荧光假单胞杆菌GH2-1、发酵上清液及其所产挥发性物质和对樱桃枝干病害病原的生长有明显的抑制效果(图6A、B、C);
抑制后的樱桃枝干病害病原菌落直径显著低于对照(图6D、E、F);
抑菌率分别为94.49%、62.51%和72.41%。以上结果说明,荧光假单胞杆菌GH2-1 及其产物能够高效抑制樱桃枝干病害病原的生长。

图6 荧光假单胞杆菌GH2-1 及其发酵产物对樱桃枝干病害病原生长的抑制效果(结果显示为平均值±标准差(n≥3)。**p<0.01)Figure 6 Inhibitory effect of Pseudomonas fluorescens GH2-1 and its products on the growth of cherry stem disease pathogens
2.4 荧光假单胞菌GH2-1 液体制剂对樱桃枝干病害防治效果
表3结果表明,最后一次施药后30 d 后,荧光假单胞菌(P.fluorescens)菌株GH2-1 液体制剂对樱桃枝干病害有较好的防治效果,防治效果为74.3%。这进一步说明菌株GH2-1 在樱桃枝干病害防治中具有广泛应用前景。
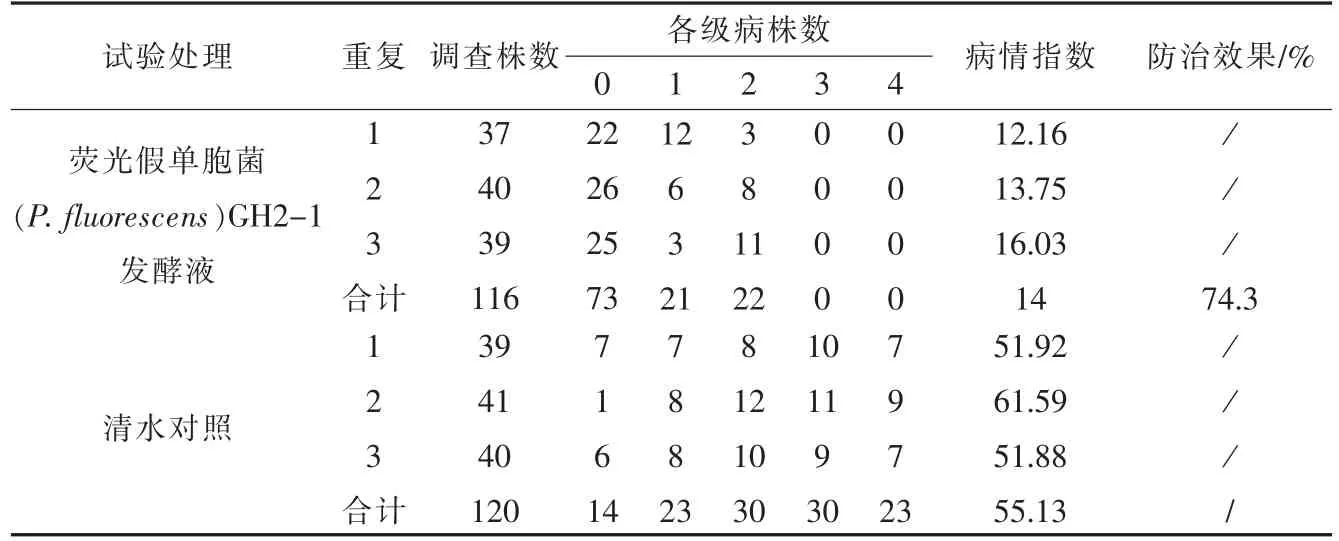
表3 各个处理后樱桃枝干病害的发病指数及防治效果Table 3 Disease index and control effect of cherry branch disease after each treatment
有文献报道,越橘间座壳(Diaporthe vaccinii)能够引起核桃枝枯病、蓝莓枝枯病的发生,但未见越橘间座壳引起樱桃枝干病害的报道[12-13]。本文从感染樱桃枝干病的樱桃枯枝中分离到病原yts-01,通过柯赫氏法则验证该菌株为樱桃枝干病害的病原,利用形态特征观察及分子生物学鉴定确定yts-01 为越橘间座壳。由越橘间座壳引起樱桃枝干病害为首次发现。鉴于该病具有传染性强、危害范围广、传播隐匿等特点,应对其生物学特性和发生发展规律进行深入研究,为后续病害防治提供更多理论依据。
生物防治因其具有环保、安全、有效、可持续等特点成为目前植物病害防治研究热点[14-15]。本文在确定越橘间座壳为樱桃枝干病害的病原的基础上,通过平板对峙实验筛选了对该病害病原有高效抑制效果的荧光假单胞杆菌GH2-1;
并对荧光假单胞菌GH2-1 的拮抗功能进行了初步研究。结果表明,荧光假单胞杆菌GH2-1、发酵上清液及其所产挥发性物质和对樱桃枝干病害病原的生长有明显的抑制效果(图6A、B、C);
抑制后的樱桃枝干病害病原菌落直径分别显著低于对照 (图6D、E、F);
抑菌率分别为94.49%、62.51%和72.41%。这表明,荧光假单胞杆菌GH2-1 及其产物能够高效抑制樱桃枝干病害病原的生长,但对于发挥作用的具体物质以及作用原理还需进一步研究。
众所周知,外界非生物因素以及寄主、其他微生物等生物因素都会严重影响微生物生防制剂在田间防效的稳定性,致使其优势难以长时间保持[16]。本文初步研究了荧光假单胞杆菌GH2-1 对樱桃枝干病害田间防效,结果表明,荧光假单胞菌GH2-1 液体制剂在樱桃枝干病害防治中具有广泛应用前景。后期,还需要根据樱桃枝干病害的发病特点以及荧光假单胞杆菌GH2-1 用药方式选择合适的剂型制成微生物菌剂,为樱桃枝干病害生物防治做出更大贡献。
猜你喜欢 病原枝干病原菌 何 芳东坡赤壁诗词(2022年4期)2022-10-30儿童细菌性腹泻的病原微生物检验结果分析健康体检与管理(2022年2期)2022-04-15细菌性食物中毒的病原菌调查与预防浅谈医学概论(2021年18期)2021-01-21植物免疫系统“合作”御敌少儿科技(2021年5期)2021-01-20玫瑰或刺意林(2020年9期)2020-06-01玫瑰或刺领导文萃(2020年7期)2020-05-15早产儿与足月儿发生新生儿败血症的特点比较中国当代医药(2016年30期)2017-01-07延安市宝塔区苹果白粉病大发生原因及对策现代园艺(2016年9期)2016-07-16- 上一篇:热带珍贵树种羯布罗香苗木质量分级标准
- 下一篇:绿道沿线文化景观呈现研究进展
猜你喜欢
- 2024-01-20 有关于第五次全国经济普查统计重点业务综合培训大会上讲话(完整文档)
- 2024-01-20 “严纪律、转作风、保安全、树形象”专题学习教育活动通知(完整文档)
- 2024-01-20 2024XX区住房城乡建设工作情况汇报
- 2024-01-20 2024高校思政教育交流材料:善用反腐败斗争这堂“大思政课”(精选文档)
- 2024-01-20 2024年主题教育专题党课辅导报告,(4)
- 2024-01-20 关于赴某地学习考察地方立法工作情况报告(范文推荐)
- 2024-01-20 2024年度关于增强党建带团建工作实效对策与建议(精选文档)
- 2024-01-20 教师演讲稿:春风化雨育桃李,,潜心耕耘满芬芳(全文)
- 2024-01-20 主题教育第二阶段来了
- 2024-01-20 2024年度关于到信访局实践锻炼个人总结【完整版】
- 搜索
-
- 打赌输了任人处理作文1000字7篇 05-12
- 当代大学生在全面建设社会主义现代化强 05-12
- 全面建成社会主义现代化强国的战略安排 03-10
- 个人廉洁自律方面存在的问题及整改措施 05-12
- 谈谈青年大学生在中国式现代化征程上的 05-12
- 2022年党支部第一议题会议记录(全文完 11-02
- 作为青年大学生如何肩负时代责任6篇 05-12
- 村党组织建设现状及工作亮点存在问题与 05-12
- 全面从严治党,自我革命重要论述研讨会 05-12
- 产业工人队伍建设改革(全文完整) 10-31
- 11-25国庆70周年庆典晚会 庆典晚会串词
- 11-25办公室礼仪的十大原则 浅谈办公室的电话礼仪
- 01-17用心灵轻轻地歌唱_心灵的歌唱
- 01-17也许你不是我一生的唯一|也许不是我
- 01-17爱了,请珍惜;不爱,趁早放手|爱就珍惜不爱就放手
- 01-17岁月带走的是记忆,但回忆会越来越清晰|有趣又有深意的句子
- 01-17曾经的美好只是曾经,我只想珍惜身边的人|我只想珍惜你
- 01-18从容不惊 [学会笑眼去看世界,不惊不乍,淡定从容]
- 02-03当代大学生学习态度调查报告
- 02-03常用护患英语会话
- 标签列表
