首页 > 心得体会 > 学习材料 / 正文
黑果枸杞花青素对人肝癌HepG2细胞凋亡与自噬相互作用的影响
2023-02-02 08:30:09 ℃刘嘉华,王梦杰,张龙飞,薛才华,武 强,武鸿莲,王 硕,吴 华
(青海大学农牧学院,青海 西宁 810016)
肝癌是全球六大高发癌症之一,其发病症状隐匿,病程较短,严重威胁着人类的健康。天然植物提取物大多具有药用价值,从天然植物提取物中寻找无毒、绿色、作用强的抗癌药物已成为目前的研究热点。黑果枸杞属于茄科、枸杞属的灌木,是我国青海、宁夏、甘肃、新疆等地特有的药用植物品种之一,是提取花青素的最佳原材料,素有“花青素之王”的美称[1]。已有研究表明,黑果枸杞花青素(Anthocyanins fromLyciumruthenicumMurr,ALR)具有降血糖、降血脂和抗氧化、抗肿瘤及提高免疫能力等特性,且其抗肿瘤作用可能是通过促进癌细胞凋亡等方式实现[2-3]。
细胞凋亡与自噬是引发细胞程序性死亡的两种方式,二者可被相同的信号通路调节或相同的刺激因素激活,在正常的生理或病理状态下发挥重要作用。凋亡与自噬之间可能存在的关系为相互促进、相互拮抗、相互独立等[4-5]。研究并利用这些交互作用,对于探究肿瘤的发生机制以及肿瘤疾病的治疗方法具有重要作用。有研究证实,花青素可通过活化自噬信号通路,抑制大鼠软骨细胞凋亡[6]。但目前关于ALR对人肝癌HepG2细胞凋亡与自噬相互作用的研究鲜见报道。基于此,本试验以黑果枸杞花青素和人肝癌HepG2细胞为研究对象,通过检测ALR结合自噬抑制剂3-MA对HepG2细胞凋亡的影响,及ALR结合JAK2/STST3凋亡通路抑制剂AG490对人肝癌HepG2细胞自噬的影响,探究二者之间的相互关系,以期为ALR的深度开发利用提供理论基础。
1.1 试验材料
人肝癌HepG2细胞购自中国科学院上海细胞库。
ALR购自青海金麦杞生物科技有限公司(花青素64.4%,蛋白6%,糖1.32%,氨基酸3.56%,灰分0.6%,其他24.12%)[7]。
1.2 试验方法
1.2.1 主要试剂配制
(1)ALR溶液。称取10 mg ALR溶于50 mL DMEM培养基,配制成200 μg/mL的溶液于4 ℃冰箱避光保存。
(2)3-MA自噬抑制剂。称取20 mg 3-MA溶于3.36 mL PBS缓冲液,配制成20 mmoL的溶液,试验浓度为5 mmoL。
(3)AG490凋亡通路抑制剂。称取10 mg AG490溶于3.398 mL DMEM培养基,配制成10 mmoL的溶液,试验浓度为10 mmoL。
1.2.2 细胞培养 使用DMEM培养基(含10%胎牛血清),将人肝癌HepG2细胞放置于37 ℃、5% CO2的细胞培养箱中进行培养,待细胞生长至70%~80%融合时进行细胞传代。收集0.1 mL对数期细胞悬液于1.5 mL离心管,加入0.8 mL PBS溶液与0.1 mL 0.4%台盼蓝染液,摇匀并在室温条件下放置2~3 min,用血球计数板在显微镜下计数。
1.2.3 分组及处理 细胞计数后,用DMEM培养基将细胞悬液稀释到1×106个/孔,取24孔细胞培养板,每孔加入500 μL的细胞稀释液,然后按分组分别加入ALR母液、AG490母液,再加入DMEM培养液调整至相应浓度,每孔终体积为2 mL,每组3个复孔,置于37 ℃、5% CO2的细胞培养箱中培养24 h后收集细胞。按照青海大学农牧学院动物营养与饲料科学课题组前期试验筛选出的ALR最佳增殖浓度(25 μg/mL)分组:①3-MA抑制剂试验组:对照组和ALR组、3-MA组、ALR+3-MA组。②AG490抑制剂试验组:对照组和ALR组、AG490组、ALR组+AG490组。
1.2.4 人肝癌HepG2细胞核形态变化检测 以每孔4×104个细胞接种至24孔培养板,按对照组和ALR组、3-MA组、ALR+3-MA组进行培养。将细胞用1% PBS洗涤2次并用4%甲醛固定,加入Hoechst染液,室温孵育30 min后再用1% PBS洗涤2次,然后使用倒置荧光显微镜观察。使用Nikon Eclipse Ti荧光显微镜捕获显微照片,并使用DS-Qi1黑白相机拍照。
1.2.5 人肝癌HepG2细胞凋亡率检测 以每孔5×106个细胞接种至24孔培养板,按对照组和ALR组、3-MA组、ALR+3-MA组进行培养。处理24 h后,离心并用PBS洗涤两次,按试剂盒说明书进行AnnexinV/PI染色后用流式细胞仪检测。
1.2.6 凋亡及自噬相关因子的mRNA表达检测 用TRNzol法分别提取各组细胞总RNA,并进行RNA完整性及浓度检测,随后按照cDNA反转录试剂盒操作说明书要求将RNA反转录为cDNA,最后采用SuperReal彩色荧光定量预混试剂盒进行定量PCR分析。qRT-PCR引物序列见表1。
1.2.7 凋亡及自噬相关因子的蛋白表达检测 分别提取各组细胞总蛋白,利用BCA蛋白定量试剂盒检测蛋白浓度。使用SDS-PAGE电泳后进行转膜及封闭,配制及加入一抗(p-JAK2抗体、p-STAT3抗体、LC3-Ⅱ抗体及GADPH抗体),4 ℃孵育过夜,加入山羊抗IgG二抗,室温下孵育1 h后洗膜,在暗室显影,并定影。采用Image J对条带吸光度(A)值进行分析。
1.3 统计学分析方法
试验数据采用统计软件(SPSS 21.0)分析,应用one-way ANOVA选择Duncan′s法进行多重比较,采用绘图软件(GraphPad Prism8.0)绘图。
2.1 ALR结合3-MA对人肝癌HepG2细胞核形态的影响
ALR结合3-MA对人肝癌HepG2细胞核形态的影响情况见图1。

图1 ALR结合3-MA对人肝癌HepG2细胞核形态的影响
图1显示,对照组细胞核核膜完整,染色均匀,呈现均匀的蓝色荧光;
与对照组相比,ALR组、3-MA组及ALR+3-MA组细胞核均呈现明亮的蓝色荧光,说明细胞发生凋亡,且ALR+3-MA组细胞凋亡特征最明显。说明抑制自噬可促进ALR诱导的人肝癌HepG2细胞凋亡。
2.2 ALR结合3-MA对人肝癌HepG2细胞凋亡率的影响
ALR结合3-MA对人肝癌HepG2细胞凋亡率的影响见图2。由图2可知,对照组细胞凋亡率为10.52%,ALR组凋亡率为18.17%,3-MA组凋亡率为18.83%,ALR+3-MA组凋亡率为22.15%。与对照组相比,ALR组、3-MA组及ALR+3-MA组细胞凋亡率明显提高。与3-MA组相比,ALR+3-MA组细胞凋亡率明显提高。说明抑制自噬可促进ALR诱导的人肝癌HepG2细胞凋亡。

图2 ALR结合3-MA对人肝癌HepG2细胞凋亡率的影响
2.3 ALR结合3-MA对人肝癌HepG2细胞凋亡相关因子mRNA表达的影响
ALR结合3-MA对人肝癌HepG2细胞凋亡相关因子mRNA表达的影响见图3。由图3可知,与对照组相比,ALR组JAK2、STAT3的mRNA表达被显著抑制(P<0.05);
3-MA组JAK2的mRNA表达被显著抑制(P<0.05),STAT3的mRNA表达被极显著抑制(P<0.01);
ALR+3-MA组JAK2、STAT3的mRNA表达被极显著抑制(P<0.01)。与3-MA组相比,ALR+3-MA组JAK2、STAT3的mRNA表达被显著抑制(P<0.05)。说明抑制细胞自噬的同时ALR可通过抑制JAK2/STAT3凋亡通路中JAK2、STAT3的mRNA表达促进细胞凋亡。

图3 JAK2和STAT3 mRNA表达水平图
2.4 ALR结合3-MA对人肝癌HepG2细胞凋亡相关蛋白表达的影响
ALR结合3-MA对人肝癌HepG2细胞凋亡相关蛋白表达的影响见图4和图5。由图4和图5可知,与对照组相比,ALR组、3-MA组、ALR+3-MA组p-JAK2、p-STAT3的蛋白表达被极显著抑制(P<0.01)。与3-MA组相比,ALR+3-MA组p-JAK2的蛋白表达被极显著抑制(P<0.01),p-STAT3的蛋白表达被显著抑制(P<0.05)。说明抑制细胞自噬的同时ALR可通过抑制p-JAK2、p-STAT3的蛋白表达促进细胞凋亡。

图4 p-JAK2和p-STAT3蛋白条带图

图5 p-JAK2和p-STAT3蛋白表达水平图
2.5 ALR结合AG490对人肝癌HepG2细胞自噬相关因子mRNA表达的影响
ALR结合AG490对人肝癌HepG2细胞自噬相关因子mRNA表达的影响见图6。由图6可知,与对照组相比,ALR组、AG490组、ALR+AG490组LC3的mRNA表达被极显著促进(P<0.01)。与AG490组相比,ALR+AG490组LC3的mRNA表达被显著促进(P<0.05)。说明促进细胞凋亡的同时ALR可通过促进LC3的mRNA表达促进细胞自噬。

图6 LC3 mRNA表达水平图
2.6 ALR结合AG490对人肝癌HepG2细胞自噬相关蛋白表达的影响
ALR结合AG490对人肝癌HepG2细胞自噬相关蛋白表达的影响见图7和图8。由图7和图8可知,与对照组相比,ALR组、ALR+AG490组自噬相关蛋白LC3-Ⅱ的蛋白表达被极显著促进(P<0.01);
AG490组自噬相关蛋白LC3-Ⅱ的蛋白表达被显著促进(P<0.05)。与AG490组相比,ALR+AG490组LC3-Ⅱ的蛋白表达被极显著促进(P<0.01)。说明促进细胞凋亡的同时ALR可通过促进LC3-Ⅱ的蛋白表达促进细胞自噬。
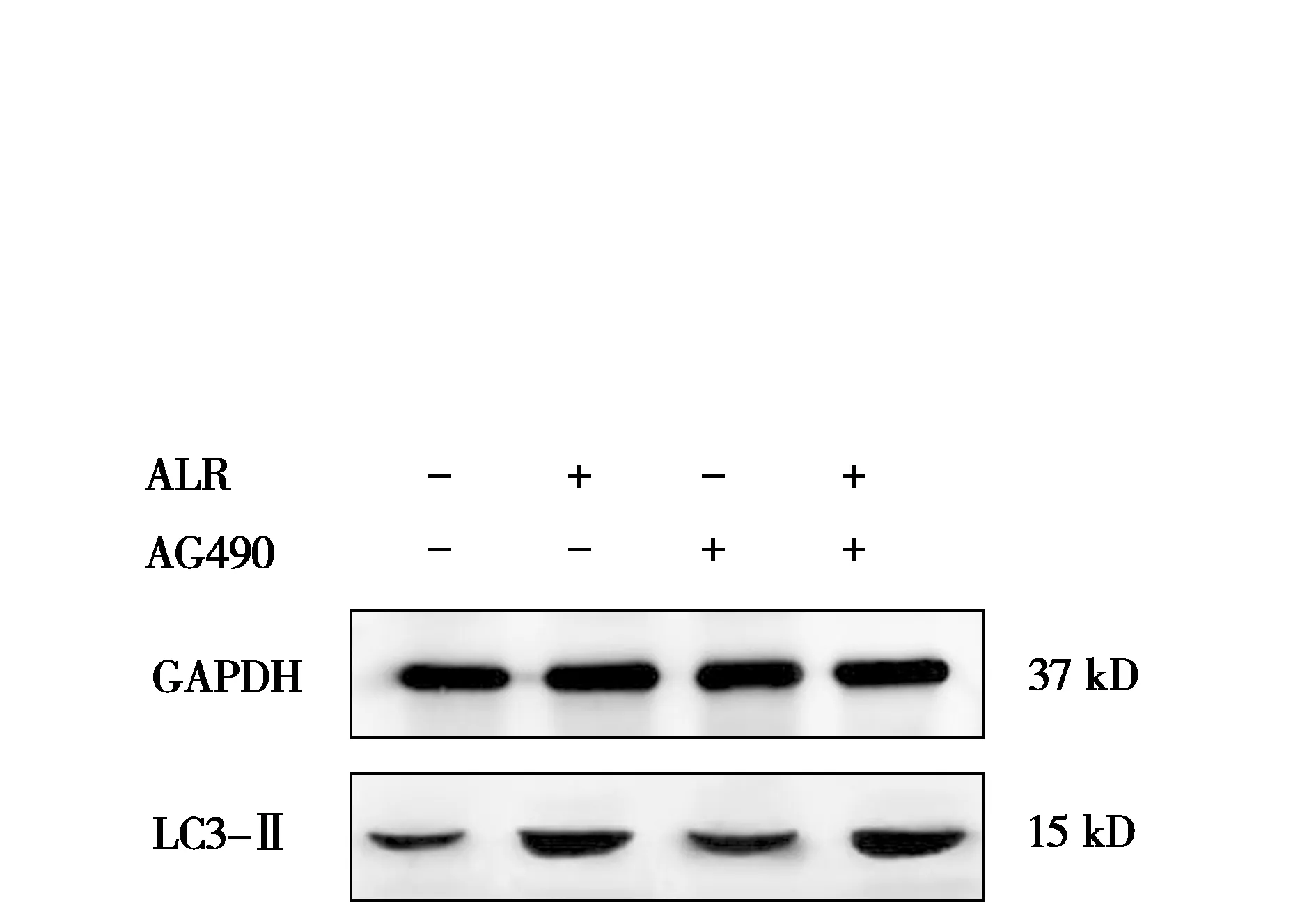
图7 LC3-Ⅱ蛋白条带图
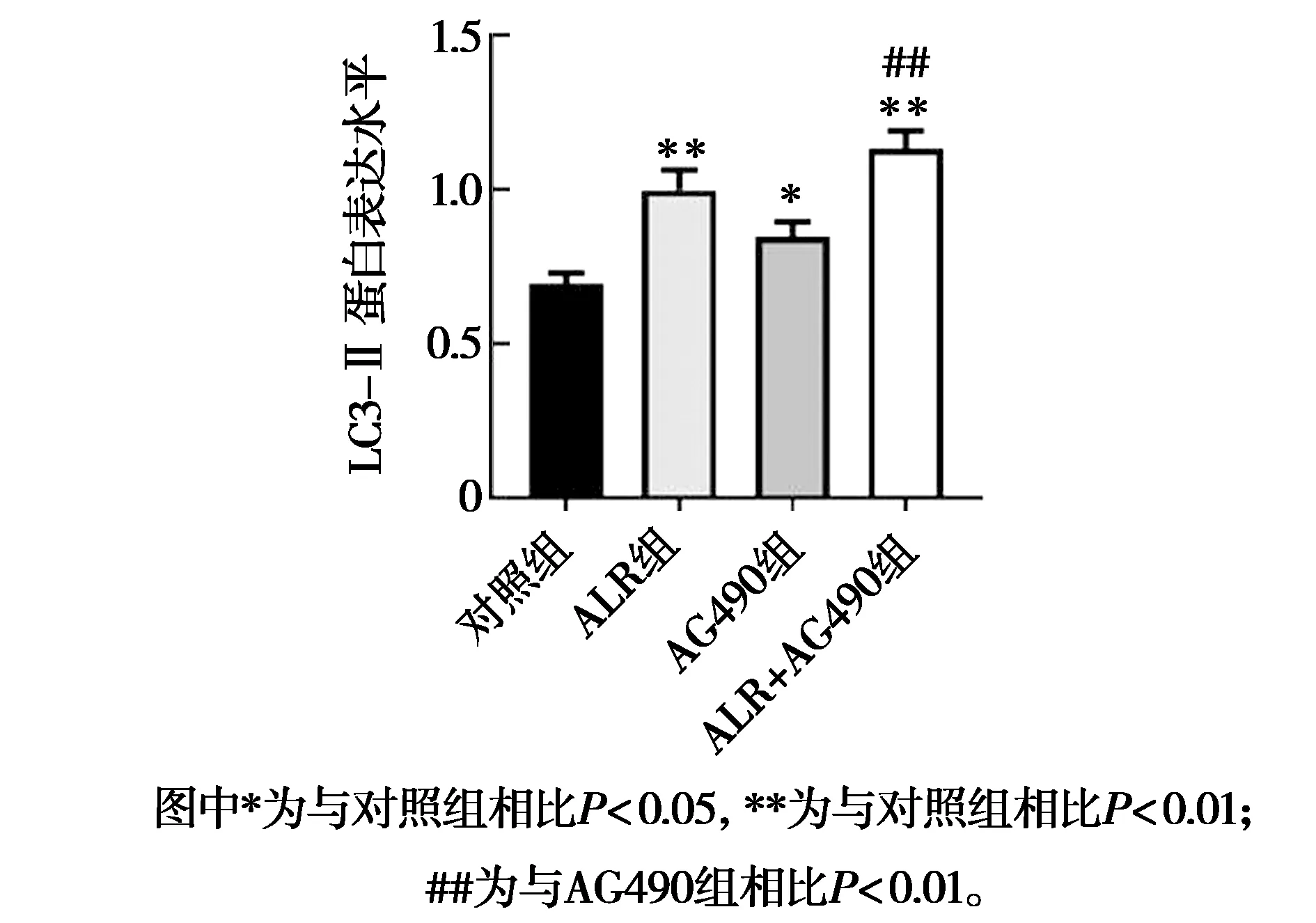
图8 LC3-Ⅱ 蛋白表达水平图
3-MA是自噬抑制剂,可通过抑制Ⅲ型PI3K及干扰自噬隔离膜的形成抑制自噬。研究已证实,3-MA可能通过经抑制饥饿处理的肿瘤细胞自噬的发生,促进肿瘤细胞凋亡[8]。在某些肿瘤的治疗中,3-MA与化疗药物合用亦能够诱导细胞凋亡[9]。JAK2/STAT3信号通路是调节癌细胞增殖与凋亡的重要通路,癌细胞的发生发展与该通路的异常激活密切相关。膜受体被激活后,引起JAK2家族蛋白酶激化,促进p-JAK2因子与p-STAT3因子表达,最终抑制癌细胞凋亡。Wang等[10]认为,自噬通过激活JAK2/STAT3信号通路抑制肺癌细胞转移。本试验结果显示,ALR结合3-MA可促进细胞核凋亡,提高细胞凋亡率,抑制JAK2/STAT3信号通路中凋亡因子p-JAK2、p-STAT3的mRNA及蛋白表达。说明抑制自噬可促进ALR诱导的人肝癌HepG2细胞凋亡。
AG490是JAK2/STAT3信号通路的特异性抑制剂,可通过阻断JAK2特异位点上丝氨酸或酪氨酸的磷酸化而阻断下游STAT3的磷酸化,起到促进细胞凋亡的作用[11-12]。有研究表明,阻断JAK2后的癌细胞可通过激活自噬因子产生自噬[13]。LC3是自噬体膜上的标记蛋白,主要参与自噬体的形成。正常情况下LC3以I型的形式存在于细胞质中,当自噬激活时会转化为LC3-II。LC3-II被认为是自噬标记物,在一定程度上反映了自噬体的数量[14-15]。余扬[16]证明AG490作用人恶性黑素瘤A357细胞72 h后,可促进LC3-II的蛋白表达。本试验结果显示,AG490可促进LC3的mRNA及LC3-II的蛋白表达,说明AG490可促进人肝癌HepG2细胞自噬。与AG490组相比,ALR结合AG490组可促进自噬因子LC3的mRNA及LC3-II的蛋白表达。说明促进凋亡可增强ALR诱导的人肝癌HepG2细胞自噬。
综上所述,ALR可诱导人肝癌HepG2细胞发生凋亡和自噬,抑制自噬可促进ALR诱导的细胞凋亡,促进凋亡可增强ALR诱导的细胞自噬。此结论可为ALR的深度开发利用提供理论基础。
猜你喜欢 花青素抑制剂肝癌 免疫检査点抑制剂相关肺炎的中西医研究现状与分析现代临床医学(2022年3期)2022-06-06PD-1抑制剂联合仑伐替尼治疗晚期肝癌的疗效分析中国典型病例大全(2022年11期)2022-05-13血管紧张素转换酶抑制剂在肾内科的应用分析健康体检与管理(2022年4期)2022-05-13质子泵抑制剂对反流性咽喉炎的疗效研究医学概论(2022年4期)2022-04-24XB130在肝癌组织中的表达及其对细胞侵袭、迁移的影响昆明医科大学学报(2021年4期)2021-07-23舒适护理在肝癌介入护理中的应用医学概论(2021年18期)2021-01-21不同处理对刺葡萄愈伤组织花青素和原花青素生物合成的影响热带作物学报(2018年12期)2018-05-14花青素在饲料上的应用探析食品界(2017年12期)2018-01-20健康Q&A 花青素Q&A现代家庭·生活版(2017年10期)2017-10-20哇,变色啦!课堂内外(小学版)(2017年1期)2017-03-08猜你喜欢
- 2024-01-20 有关于第五次全国经济普查统计重点业务综合培训大会上讲话(完整文档)
- 2024-01-20 “严纪律、转作风、保安全、树形象”专题学习教育活动通知(完整文档)
- 2024-01-20 2024XX区住房城乡建设工作情况汇报
- 2024-01-20 2024高校思政教育交流材料:善用反腐败斗争这堂“大思政课”(精选文档)
- 2024-01-20 2024年主题教育专题党课辅导报告,(4)
- 2024-01-20 关于赴某地学习考察地方立法工作情况报告(范文推荐)
- 2024-01-20 2024年度关于增强党建带团建工作实效对策与建议(精选文档)
- 2024-01-20 教师演讲稿:春风化雨育桃李,,潜心耕耘满芬芳(全文)
- 2024-01-20 主题教育第二阶段来了
- 2024-01-20 2024年度关于到信访局实践锻炼个人总结【完整版】
- 搜索
-
- 打赌输了任人处理作文1000字7篇 05-12
- 当代大学生在全面建设社会主义现代化强 05-12
- 全面建成社会主义现代化强国的战略安排 03-10
- 个人廉洁自律方面存在的问题及整改措施 05-12
- 谈谈青年大学生在中国式现代化征程上的 05-12
- 2022年党支部第一议题会议记录(全文完 11-02
- 作为青年大学生如何肩负时代责任6篇 05-12
- 村党组织建设现状及工作亮点存在问题与 05-12
- 全面从严治党,自我革命重要论述研讨会 05-12
- 产业工人队伍建设改革(全文完整) 10-31
- 11-25国庆70周年庆典晚会 庆典晚会串词
- 11-25办公室礼仪的十大原则 浅谈办公室的电话礼仪
- 01-17用心灵轻轻地歌唱_心灵的歌唱
- 01-17也许你不是我一生的唯一|也许不是我
- 01-17爱了,请珍惜;不爱,趁早放手|爱就珍惜不爱就放手
- 01-17岁月带走的是记忆,但回忆会越来越清晰|有趣又有深意的句子
- 01-17曾经的美好只是曾经,我只想珍惜身边的人|我只想珍惜你
- 01-18从容不惊 [学会笑眼去看世界,不惊不乍,淡定从容]
- 02-03当代大学生学习态度调查报告
- 02-03常用护患英语会话
- 标签列表
