首页 > 心得体会 > 学习材料 / 正文
纳米疫苗的发展与应用*
2023-02-08 18:30:08 ℃吕蔚林,陈朝霞,雍土莹,甘璐,杨祥良
(1.华中科技大学生命科学与技术学院,武汉 430074;
2.国家纳米药物工程技术研究中心,武汉 430074)
自1796年第一剂牛痘疫苗发明以来,针对不同疾病的疫苗被逐步研发并应用于临床。按照发展历程,疫苗可大致分为三代:第一代为灭活疫苗或减毒活疫苗,第二代为基因工程疫苗,第三代为核酸疫苗。为进一步减少不良反应,提高疫苗顺应性,增强疫苗效价,诱导持久的免疫反应,人类需要一种高效的递送系统,既能把抗原递送到靶点激活持久的免疫反应,又能减少毒副作用。
近年来,纳米载体技术快速发展,在改善药动学、提高药物生物利用度等方面效果显著。纳米载体技术可实现佐剂和抗原有效封装与递送,提高抗原稳定性,增加抗原装载量,为多种途径接种疫苗(如口服给药、吸入给药等)提供了可能。同时,纳米技术可将纳米疫苗加工为免疫反应的靶点,一旦纳米疫苗被抗原呈递细胞(antigen-presenting cells,APCs)内化,纳米颗粒可诱导炎症体复合物形成,促进炎性细胞因子分泌、免疫细胞招募等。此外,调控纳米疫苗的形状、粒径、电荷或进行表面修饰等可增强疫苗组织靶向性,提高摄取效率,减少细胞毒性等。
目前常见的纳米疫苗包括脂质纳米颗粒疫苗、有机高分子聚合物纳米疫苗、无机纳米颗粒疫苗、病毒载体疫苗、生物膜纳米粒疫苗等几大类。利用不同的载体制备纳米疫苗可以有针对性地实现绕开生理屏障、靶向递送、溶酶体逃逸、免疫激活等目标。笔者在本文概述纳米疫苗在传染病预防和肿瘤免疫治疗中的应用进展。
脂质纳米颗粒主要包括胶束、乳剂、固体脂质纳米粒(solid lipid nanoparticles,SLN)、纳米结构脂质载体(nanostructed lipid carriers,NLC)、脂质体(liposomes)等。脂质纳米颗粒主要由脂质或类脂质分子组成,可通过吸附、包载等方式携带抗原,具有结构稳定、生物相容性好、可以携带抗原佐剂实现体内长循环、增强细胞对抗原的识别摄取及增强组织靶向等优点。但为了在体内更好发挥作用,脂质纳米颗粒仍需要解决抗原或mRNA等物质容易降解[1]、肾脏对纳米粒的截留[1]、纳米粒难以靶向特定组织、纳米粒难以实现核内体逃逸[2]、佐剂造成的炎症或毒性等一系列问题。
为增强纳米粒的稳定性和血液滞留时间,有文献报道采用聚乙二醇(polyethylene glycol,PEG)对脂质纳米颗粒进行修饰(图1A,图1B),可以通过减少颗粒聚集从而增强脂质纳米粒稳定性[3],并通过增加脂质纳米粒的亲水性减少单核吞噬细胞系统(mononuclear phagocyte system,MPS)对脂质纳米颗粒的清除,延长血液循环时间[4]。PEG的分子量可以在350~3000,脂质锚的长度可以在10~18碳[5],一般较大的分子量和较长的长度可以减少MPS的清除作用,增加纳米粒在血液中的滞留。此外,PEG修饰可增加亲水性从而使纳米粒更容易穿透黏膜屏障[6],有利于喷雾剂型疫苗的发展。
纳米颗粒可以通过表面修饰实现组织或器官靶向并促进细胞摄取。KEDMI等[7]利用一种膜锚定脂蛋白(anchored secondary scFv enabling targeting,ASSET)开发了一种细胞特异性小干扰RNA(small interfering RNA,siRNA)递送平台(图1C),其一端整合到脂质纳米颗粒上,一端与抗体的Fc片段相连,实现在脂质纳米颗粒表面非共价包被靶向抗体。ZOHRA等[8]在N-[1-(2,3-二油氧基)丙基]-N,N,N-三甲基氯化铵的阳离子脂质体中加入无机碳酸盐磷灰石,形成阳离子脂质体-磷灰石复合物,大大提高了转染效率。MOON等[9]构建了一种双层间交联的多层膜囊泡(interbilayer-crosslinked multilamellar vesicles,ICMVs),通过短的共价交联键稳定多层囊泡形成,这些短链将脂质头基连接在囊泡壁内相邻紧密堆叠的双层的相对面上(图1D)。与相同脂质组成的简单脂质体或多层囊泡(multilamellar vesicles,MLVs )相比,ICMVs封装并保留了更多抗原蛋白,并在暴露于血清(超过30 d)时缓慢释放蛋白(图1E),在胞内脂肪酶作用下实现快速降解。通过对小鼠免疫发现,ICMVs引起的强效抗体滴度比简单脂质体提高约1000倍,比相同脂质成分的MLVs提高约10倍。

A.PEG修饰的载mRNA脂质纳米颗粒结构示意图[3];
B.在血清白蛋白存在的情况下,纳米粒结构和脂质-PEG分离的示意图[14];
C.膜锚定脂蛋白链接抗体至脂质纳米颗粒表面示意图[8];
D.ICMVs合成示意图及电镜图;
E.ICMVs与其他结构脂质体抗原释放速率对比[9]。
由于大部分脂质纳米粒进入细胞后主要聚集于核内体,因此,增强脂质纳米粒的核内体逃逸至关重要。筛选合适的阳离子脂质,改变可电离脂质的比例、pKa或脂质尾部的性质等可以促进溶酶体逃逸发生。ELIA等[10]利用荧光素酶mRNA的体内表达来筛选利于核内体逃逸的可电离脂质。JAYARAMAN等[11]利用6-对甲苯胺基萘磺酸与带正电的膜结合时发生荧光而在自由溶液中不发光的特性,检测不同PKa下阳离子脂质释放情况。HAJJ等[12]发现具有相同分子量及相同碳数尾链的两个脂质分子,由于一个的尾部呈直线,另一尾部有一单碳分支,导致支链尾脂质分子构建的载体疗效增强10倍,并将这种现象归因于其在pH值为5.0的晚期核内体的强表面电离作用。
脂质纳米载体也可以通过增强免疫激活效果、减少佐剂用量来削弱疫苗佐剂的不良反应。PANDIT等[13]证明,与普通Toll样受体4(Toll-like receptors 4,TLR4)激动剂结合疫苗相比,TLR4激动剂结合的多层“锚定”脂囊泡疫苗佐剂的使用剂量可降至10%但却诱导更强的体液免疫反应。此外,部分纳米颗粒本身就具备佐剂的性质,即使没有TLR配体或其他佐剂也可以引起B细胞激活、补体激活等。
脂质体纳米疫苗具有良好的生物安全性,产业化技术成熟,大规模生产方便,目前已有Epaxal®、Inflexal®V、Stimuvax®等多款产品上市。然而,目前脂质体纳米疫苗的临床应用仍面临着免疫载体佐剂功能差、大分子药物装载困难、不易被细胞摄入、长期储存过程中易发生粒径增大、絮凝等问题。通过调控脂质体的脂质成分、理化性质、对脂质体表面修饰等,有望推动脂质体纳米疫苗临床应用。
聚合物纳米颗粒有生物可降解性、良好的生物相容性、安全性和缓释性,部分聚合物还可作为佐剂,增强疫苗的免疫激活效率。常用于纳米疫苗载体的聚合物包括天然聚合物纳米载体、合成聚合物纳米载体。天然聚合物包括壳聚糖、海藻酸盐、透明质酸、支链淀粉、菊粉、葡聚糖等。这些生物来源聚合物分子大部分存在于细菌、酵母等微生物中,可被人体APCs识别并激活免疫反应。

壳聚糖是由 α(1-4) 2-氨基2-脱氧-β-D葡聚糖-氨基葡萄糖和n-乙酰氨基葡萄糖的共聚物组成的天然线性多聚氨基糖。壳聚糖带正电荷,可以与带负电的mRNA强结合作为核酸递送载体。研究表明,壳聚糖具备明显的生物粘附性,可以延长抗原在黏膜上的滞留时间[17],打开上皮细胞紧密连接进而增强免疫应答。壳聚糖可诱导产生强大的免疫激活反应。PANDIT等研究发现,聚乳酸[poly(lactic acid),PLA]-明矾和PLA-壳聚糖微球诱导乙型肝炎病毒表面抗原(hepatitis B surface antigen,HBsAg)血清特异性抗体反应,显著优于PLA微球和游离抗原[18]。壳聚糖不仅能使微粒表面带正电荷,而且可以通过化学修饰改善其溶解度、亲水性、亲脂性、靶向性,改变纳米粒子的粒径和Zeta电位。然而,壳聚糖在生理条件下易沉淀[19],生产过程中的杂质难以去除,可能导致严重的免疫反应,极大地限制了其进一步临床应用。
合成聚合物主要包括聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]、聚己内脂、聚酸酐、树状大分子、聚乳酸[poly(lactic acid)]等。聚羟基乙酸[poly(glycolic acid),PGA]是一种高度结晶的材料。与PGA相比,PLA结构中附加的甲基增加了疏水性和抗水解稳定性,通常用于较长时间内的抗原可控或脉冲释放[20]。KANCHAN等[21]发现用明矾和PLA聚合物颗粒(直径2~8 μm)包埋抗原后进行体内免疫后可产生长效抗体,且当机体再次暴露于极少量的可溶性抗原后会产生非常高水平的记忆抗体滴度,是一类极具潜力的纳米疫苗载体。目前已有大量工作具体研究PLA在纳米疫苗方面的应用。
PLGA是由PLA和PGA无规聚合而成的共聚物[22]。PLGA具有树突状细胞(dendritic cells,DCs)靶向、稳定性高、易加工、缓释等诸多优点[23](图2A,B),作为疫苗递送平台广泛用于疟疾、利什曼病、乙型肝炎和埃博拉等疾病[24]。基于PLGA/PLA的纳米颗粒能够以可控和持续的方式将包被的抗原递送到APCs(图2C)[25]。通过控制单体比例、化学修饰等有望改善PLGA疏水性与药物释放特性,产生持久的免疫反应与免疫记忆(图2D)[22]。
树状大分子是一种纳米大小、径向对称的分子,具有明确的、均匀的、单分散的结构(图2E)。研究发现低代数的树状大分子与高代数的树状大分子相比,生物相容性更好,免疫原性更强[26-27]。大分子电荷、代数均可控,有非常多的可供表面修饰的位点,可以根据不同的需求设计相应的大分子,有望成为一种重要的新型纳米疫苗载体。

A.溶剂蒸发法制备包埋抗原的PLGA微球示意图[19];
B.PLGA微球包覆重组HBsAg的扫描电镜照[23];
C.通过改变聚乳酸与羟基乙酸比例可以调控抗原释放速率[25];
D.PLA载体疫苗产生了更强的免疫记忆[22];
E.树突大分子、树突和多重抗原肽系统的结构示意图[27](①与铝佐剂对照组相比,P>0.05;
②与铝佐剂对照组相比,P<0.001)。
无机材料生物降解性低,结构稳定。作为纳米疫苗载体,无机纳米材料需要进行修饰,改变理化特性,以提高其生物相容性。一些无机材料,例如金、硅纳米粒子,由于其固有的佐剂样功能而被用于增强抗原免疫原性。
金纳米粒具有良好的生物相容性、低免疫原性和高抗原负载能力,且具有强大的免疫刺激能力,可诱导炎性细胞因子的产生(图3A)[28]。ALMEIDA等[29]报道与金纳米粒偶联模式抗原OVA(AuNP-OVA)可防止抗原肽降解并将抗原靶向递送至APCs。皮下给药AuNP-OVA后,DCs释放大量的细胞因子,诱导小鼠产生强烈的抗原特异性反应(图3B)。DRAZ等[30]报道了一种基于体内电刺激金纳米粒子进行DNA疫苗接种的方法。等离子体纳米粒子的电激发可以破坏附近细胞膜,结合金纳米粒在细胞表面的聚焦和放大电场的能力,显著诱导细胞穿孔并促进DNA疫苗的吸收。与对照组(没有纳米颗粒)相比,使用此疫苗免疫的小鼠体内基因表达水平高100倍,且针对丙型肝炎病毒的抗体和细胞免疫反应水平显著提高。
LI等[31]报道了一种基于多孔硅、金纳米复合材料作为颗粒核来制备仿生纳米疫苗用于实体瘤免疫治疗的策略。据报道,这些外源性的纳米颗粒核心可以有效地将肿瘤细胞膜递送到树突状细胞中,以激活抗原递呈细胞和下游的抗肿瘤免疫。此外,这种纳米疫苗可作为一种光热治疗剂,与其他免疫疗法协同作用,通过启动体内抗肿瘤免疫反应、减弱免疫抑制微环境,显著抑制肿瘤的生长和转移。
不同形态及孔径的硅颗粒具有可变的孔隙率(图3C,图3D),可增加不同抗原和佐剂的负载率,增强纳米疫苗的靶向递送和摄取[32-33](图3E)。LI等[34]发展了一种介孔二氧化硅微棒,可通过静电相互作用依次吸附聚乙烯亚胺(polyethylene endomine,PEI)和肿瘤新抗原,3 h内快速制造肿瘤疫苗。研究发现,PEI与介孔二氧化硅微棒可协同激活APCs并诱导炎性细胞因子的分泌,显示出强大的抗肿瘤疗效。碳纳米管(carbon nano tube,CNTs)是一种用于递送抗原和佐剂的另一个前瞻性平台。CNTs可负载肿瘤睾丸抗原NY-ESO-1和佐剂 CpG,构建具备明显抑瘤效果的肿瘤疫苗[35]。金属有机框架(metal-organic frame,MOF)通过将金属离子或簇连接到有机配体构建而成,基于MOF的平台也可用于制备肿瘤疫苗[36]。
无机纳米颗粒主要通过静电吸附等方式携带抗原,易导致抗原不稳定,疫苗难以长期保存。因此,迫切需要发展能够稳定携带抗原的新策略以增强无机纳米颗粒疫苗的进一步临床应用。
病毒样颗粒(virus-like particles,VLPs)是由某种病毒的一个或多个结构蛋白自组装而成的、高度结构化的复合物。VLPs主要通过病原体相关分子模式(pathogen-associated molecular patterns,PAMPs)激活免疫反应。PAMPs被模式识别受体识别为外来物质后导致细胞因子的级联反应和APCs激活,有效激活体液免疫和细胞免疫[37]。基于上述特点,VLPs是一种非常理想的疫苗开发平台(图4A)。目前,已有多款基于VLP的疫苗成功上市,包括针对人乳头瘤病毒的Cervarix®和Gardasil®,以及针对肝炎病毒的Sci-B-VacTM疫苗。基于VLPs的新冠疫苗富含S、M、E和(或)N抗原表位,具有高度免疫原性,可直接结合B细胞受体以激活B细胞,在小鼠中产生高浓度的中和抗体[38]。在临床前研究中,也有报道通过使用Matrix-M1 佐剂以及装载SARS-CoV和MERS-CoV的全长S蛋白的VLPs,可极大提高冠状病毒中和抗体水平[39-40]。

A.金纳米疫苗的合成、功能化修饰与应用[28];
B.金纳米疫苗促进脾细胞释放IFN-γ[28];
C.多孔硅微球的扫描电镜图片[32];
D.调节正硅酸四乙酯在环己烷中的浓度合成不同孔径的单分散二氧化硅微球[32];
E.负载抗原的二氧化硅微球肿瘤疫苗显著抑制肿瘤生长[33](①P<0.05;
②P<0.01;
③P<0.001)。
抗肿瘤研究中使用最多的是二十面体植物病毒的豇豆花叶病毒(cowpea mosaic virus,CPMV),其衣壳大小约为28 nm。CPMV可在体外与APCs结合并被内化[41]。腹腔注射后,CPMV蓄积于淋巴结并被APCs摄取,诱导APCs激活[42](图4B,C,D,E)。接种CPMV疫苗后小鼠各器官未见明显的损伤或炎症迹象,表明CPMV具备良好的生物安全性[43]。VLP疫苗接种也可与放射疗法、化学疗法或免疫疗法联合使用来发挥抑瘤作用[44-46]。

A.拟病毒纳米颗粒疫苗制备示意图[48];
B.CPMV促进骨髓来源DC细胞体外细胞因子的释放[43];
C,D,E.CPMV有效抑制B16-F10黑色素瘤肺转移[43](①P<0.001;
②P<0.01)。
病毒载体疫苗可被APCs摄取并协同PAMPs激活强大的免疫反应,其自身无复制感染能力且具有大规模生产基础,已经作为一种理想的纳米疫苗载体开发上市。现阶段病毒载体疫苗的研发需要考虑如何克服“预存免疫”难题,即患者如果曾经感染过该种病毒,其体内可能存在病毒相关抗体,导致疫苗有效性显著降低。同时,应警惕病毒自身可能产生的强烈炎症、组织坏死等不良后果。
作为疫苗材料,仿生纳米材料功能多样,可以高效递送抗原至目标部位,同时具有高生物相容性、长时间体内循环、独特的抗原特性、良好的柔韧性等优点。
目前,大量研究利用仿生纳米材料制备疫苗。例如,WANGA等[47-48]利用聚多巴胺将带有病毒抗原和Toll样受体激动剂的仿生纳米颗粒修饰在红细胞表面,显著增强体内抗病毒免疫反应(图5A)。由于红细胞可归巢靶向脾脏并与APCs相互作用,锚定仿生病毒纳米颗粒的红细胞可将病毒抗原高效递送到DCs。与对照组相比,仿生纳米颗粒修饰的红细胞在小鼠体内成功刺激DCs成熟和活化、S1 特异性免疫球蛋白G(immunoglobulins G,IgG) 抗体的产生和T细胞免疫应答(图5B)。由于聚多巴胺在结合不同分子结构方面具有易操作性和普适性,可装载其他多种抗原,可作为通用平台开发针对多种疾病的疫苗。
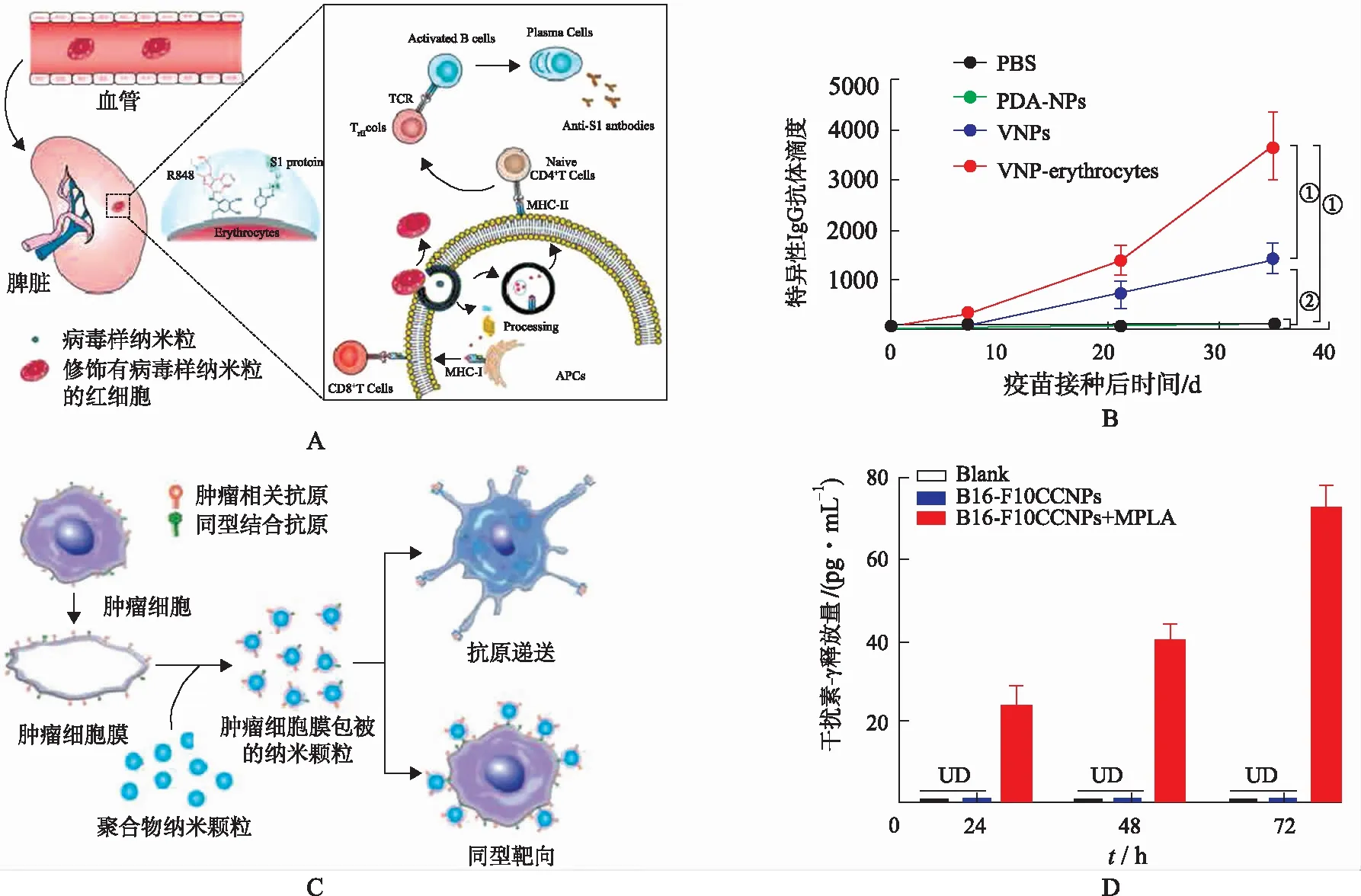
A.表面锚定负载病毒抗原与Toll样受体激动剂的仿生纳米颗粒的红细胞疫苗[47];
B.经过修饰的红细胞疫苗诱导抗体产生[47];
C.肿瘤细胞膜包被聚合物颗粒作为肿瘤疫苗示意图[49];
D.肿瘤细胞膜包被的肿瘤疫苗促进IFN-γ分泌[50](①P<0.001;
②P<0.01)。
FANG等[49-50]发展了肿瘤细胞膜包裹的纳米颗粒(cancer cell membrane-coated nanoparticles,CCNPs),可作为肿瘤疫苗用于肿瘤高效治疗(图5C)。这些纳米颗粒通过多种机制发挥抗肿瘤作用:① CCNPs 携带完整的肿瘤相关抗原,与佐剂共同递送显著增强抗原递呈细胞活化和抗原呈递水平;
②肿瘤细胞膜来源于自体肿瘤组织,固有的同源结合能力增强CCNPs肿瘤靶向作用。JIANG等[51]对其进一步优化,设计了一种表达共刺激信号分子的肿瘤细胞膜仿生纳米颗粒平台,此体系可无需APCs直接刺激T细胞活化(图5D)。CNNPs纳米疫苗平台包含存在于膜表面的天然抗原表位,并且通过与T细胞受体和CD28的结合直接刺激肿瘤抗原特异性T细胞激活,通过杀死表达相关抗原的肿瘤细胞而达到抑瘤目的。
细菌外膜囊泡(outer membrane vesicles,OMVs)由革兰阴性菌外膜形成,内含传递细菌信号的生化物质,包括DNA、RNA、蛋白质、内毒素和相关的毒力分子等。OMVs直径50~250 nm,具有很好的淋巴结归巢和APCs靶向递送能力。细菌来源OMVs中免疫刺激“危险信号”使OMV成为极具吸引力的免疫佐剂。大量研究报道OMVs作为抗菌疫苗和抗癌疫苗[52-54]。例如,类鼻疽伯克霍尔德菌OMVs免疫的小鼠表现出T细胞记忆反应和对类鼻疽伯克霍尔德菌和鼻疽假单胞菌的交叉保护[55]。在铝佐剂协同作用下,铜绿假单胞菌OMVs作为抗原能够刺激小鼠产生免疫反应,显著降低铜绿假单胞菌感染的致死率[56]。作为免疫佐剂,OMVs也可应用于肿瘤治疗领域,例如OMVs可诱导干扰素-γ依赖的抗肿瘤反应并促进抗肿瘤相关细胞因子产生[57]。最新的研究表明,改造后的OMVs可靶向肿瘤组织。研究者将磷酸钙壳覆盖OMVs表面用于肿瘤治疗,可有效重塑肿瘤微环境,且无明显毒副作用。同时,pH敏感的磷酸钙壳可中和肿瘤酸性环境,诱导巨噬细胞从促进肿瘤生长的M2型向抑制肿瘤生长的M1型转变,显著提高抗肿瘤疗效[58]。
生物膜仿生纳米疫苗有望成为新一代纳米疫苗的主力军,但是制备工艺普遍复杂、难以大规模生产、产品成分复杂、生产成本高等限制了其进一步临床应用。
目前纳米疫苗已逐步用于防治传染病或治疗肿瘤,并表现出良好的治疗效果。2021年4月22日公布的辉瑞公司新型冠状病毒mRNA疫苗BNT162b1在中国的I期临床试验数据显示,BNT162b1在年轻和年长的中国成年人中均诱导了对包括RBD在内的多肽库的强大干扰素-T细胞应答[59]。一种称为DermaVir的PEI纳米颗粒疫苗已经完成了II期(NCT00711230)临床试验,目前正在向III期临床试验发展。DermaVir通过靶向输送人类免疫缺陷病毒(human immunodeficiency virus, HIV)核酸物质至表皮树突状细胞前体、朗氏细胞,诱导其表达大量病毒结构基因和调节基因,刺激特异性T细胞免疫应答。临床试验证明,DermaVir可降低约70%的HIV-RNA表达。纳米疫苗在临床治疗中展现出令人惊喜的效果,但随着临床研究的深入,也面临着一些挑战,例如载体体内降解困难导致蓄积并产生不良反应;
抗体、佐剂包封率不高且递送过程不稳定;
合成步骤复杂、生产成本高、质量把控困难、产品均一性差等。选取生物相容性好的纳米载体、构建自组装纳米疫苗体系、设计个性化治疗疫苗等是未来纳米疫苗潜在的发展方向。
传统疫苗存在稳定性差、免疫原性低、难以靶向递送、且大剂量的佐剂易产生不良反应等不足,已难以满足社会需求。纳米疫苗是基于纳米技术的新一代疫苗,可以通过载体设计、表面配体修饰等方式诱导长期、有效的免疫反应,具有很好的临床应用前景。然而,纳米疫苗也存在一些问题,例如载药效率低、不易长期储存、成本较高难以大规模生产等困难,但随着纳米技术的发展与生产工艺的优化,未来会有越来越多的纳米疫苗逐步临床转化,为传染病预防与肿瘤治疗带来新的希望。
猜你喜欢 佐剂脂质抗原 纳米氢氧化铝佐剂的制备及其相关性质分析中国生物制品学杂志(2022年9期)2022-09-17茶叶中脂质含量检测及其方法比较浙江大学学报(农业与生命科学版)(2022年4期)2022-09-07苏州市D抗原阳性无偿献血者C和e抗原阴性率及其筛血策略*交通医学(2022年2期)2022-06-14新型铝佐剂助力疫苗研发科学导报(2022年17期)2022-04-02BC02 复合佐剂成分协同增强机体固有免疫应答的分析中国生物制品学杂志(2022年1期)2022-01-19脂质过氧化在慢性肾脏病、急性肾损伤、肾细胞癌中的作用现代临床医学(2021年6期)2021-11-20疫苗中的“隐形守护者”知识就是力量(2021年7期)2021-07-28负载抗原DC联合CIK对肝癌免疫微环境的影响昆明医科大学学报(2021年1期)2021-02-07肽基脯氨酰同分异构酶(Pin1)对子宫颈癌细胞脂质代谢的作用昆明医科大学学报(2021年1期)2021-02-07中年发福或与脂质周转有关保健与生活(2019年23期)2019-09-10猜你喜欢
- 2024-01-20 有关于第五次全国经济普查统计重点业务综合培训大会上讲话(完整文档)
- 2024-01-20 “严纪律、转作风、保安全、树形象”专题学习教育活动通知(完整文档)
- 2024-01-20 2024XX区住房城乡建设工作情况汇报
- 2024-01-20 2024高校思政教育交流材料:善用反腐败斗争这堂“大思政课”(精选文档)
- 2024-01-20 2024年主题教育专题党课辅导报告,(4)
- 2024-01-20 关于赴某地学习考察地方立法工作情况报告(范文推荐)
- 2024-01-20 2024年度关于增强党建带团建工作实效对策与建议(精选文档)
- 2024-01-20 教师演讲稿:春风化雨育桃李,,潜心耕耘满芬芳(全文)
- 2024-01-20 主题教育第二阶段来了
- 2024-01-20 2024年度关于到信访局实践锻炼个人总结【完整版】
- 搜索
-
- 打赌输了任人处理作文1000字7篇 05-12
- 当代大学生在全面建设社会主义现代化强 05-12
- 全面建成社会主义现代化强国的战略安排 03-10
- 个人廉洁自律方面存在的问题及整改措施 05-12
- 谈谈青年大学生在中国式现代化征程上的 05-12
- 2022年党支部第一议题会议记录(全文完 11-02
- 作为青年大学生如何肩负时代责任6篇 05-12
- 村党组织建设现状及工作亮点存在问题与 05-12
- 全面从严治党,自我革命重要论述研讨会 05-12
- 产业工人队伍建设改革(全文完整) 10-31
- 11-25国庆70周年庆典晚会 庆典晚会串词
- 11-25办公室礼仪的十大原则 浅谈办公室的电话礼仪
- 01-17用心灵轻轻地歌唱_心灵的歌唱
- 01-17也许你不是我一生的唯一|也许不是我
- 01-17爱了,请珍惜;不爱,趁早放手|爱就珍惜不爱就放手
- 01-17岁月带走的是记忆,但回忆会越来越清晰|有趣又有深意的句子
- 01-17曾经的美好只是曾经,我只想珍惜身边的人|我只想珍惜你
- 01-18从容不惊 [学会笑眼去看世界,不惊不乍,淡定从容]
- 02-03当代大学生学习态度调查报告
- 02-03常用护患英语会话
- 标签列表
