首页 > 心得体会 > 学习材料 / 正文
免疫相关基因FGF13、GZMB、FLT3、CRLF3可能与急性髓系白血病患者预后密切相关
2023-02-26 17:35:05 ℃刘琼芝,黄文丽
(1.长沙市中心医院,长沙 410028;
2.长沙金域医学检验实验室有限公司,长沙 410205)
急性髓系白血病(acute myeloid leukemia,AML)是成人急性白血病中最常见的一种,其发病率随着年龄增长逐渐增加,且患者预后较差[1]。现今,AML的主要治疗方式为化疗、靶向治疗和造血干细胞移植,这使AML患者病情有所缓解[2],但在临床表现和治疗预后方面,患者之间存在较大的异质性。进一步探究发现,这种异质性更加体现在基因层面,复发的原因可能与部分白血病细胞发生免疫逃逸,从而在骨髓中形成残留病灶有关[3-4]。因此,进一步探究AML的骨髓微环境对于优化治疗方案以及提高 AML患者的生存率具有重要的意义。虽然既往有许多分析肿瘤微环境中免疫细胞构成与预后之间关系的研究,但关于AML的研究较少[5]。本研究根据免疫基因构建预后风险模型,比较高风险组和低风险组AML患者之间骨髓微环境中免疫细胞的分布比例,进而分析风险模型与AML的免疫细胞浸润模式的相关性及其预后价值,旨在为改善AML治疗和预后效果提供新的方向。
1.1 TCGA数据库分析
通过癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库(https://portal.gdc.cancer.gov/)下载141例AML(TCGA-LAML)样本的RNA表达数据以及生存等临床信息。本研究通过基因表达综合(Gene Expression Omnibus,GEO)数据库(http://www.ncbi.nlm.nih.goc/geo/)下载转录组RNA测序数据集GSE15601,其中包括69例正常对照和202例AML患者的骨髓样本。
1.2 筛选差异表达基因及获取相关免疫基因、候选基因
通过R软件包limma,以P<0.05为阈值,筛选数据集GSE15601中正常对照与AML患者的骨髓样本间的差异表达基因。从IMMPORT数据库(https://www.immport.org/home)中下载人类免疫及免疫相关基因。利用jvenn工具(http://jvenn.toulouse.inra.fr/)取数据集GSE15601中差异表达基因与免疫基因的交集,并绘制Venn图,得到候选基因。
1.3 构建预后风险模型
使用TCGA-LAML数据集,采用R语言包survival对55个免疫基因进行单因素COX回归分析以及多因素COX回归分析,建立预后风险模型,并计算回归模型下每位患者的风险评分。风险评分=各基因回归系数×其表达水平之和。
1.4 绘制生存分析曲线和接受者操作特性曲线(ROC)
根据风险评分的中位值将患者分为高风险组和低风险组,并进行Kaplan-Meier生存分析,以比较高风险组和低风险组之间的总体生存期(overall survival,OS)差异,选择P<0.05作为截止值。同时绘制风险曲线和生存状态图,并基于R软件包pheatmap绘制4个预后基因在高风险组和低风险组中表达的热图。采用R软件包timeROC进行分析,绘制接受者操作特性曲线(receiver operating characteristic curve,ROC)以评估预后风险模型的准确性。
1.5 绘制临床相关性分析和列线图
基于TCGA-LAML数据集中AML患者的年龄(≤65和>65)、性别(男和女)进行分组,比较组间风险评分的差异。根据患者临床信息(年龄、性别、生存时间)以及风险评分,采用R软件包rms绘制列线图,以评估AML患者的预后。
1.6 肿瘤微环境分析
ESTIMATE是一种预测肿瘤纯度的工具,可基于基因表达数据预测肿瘤组织中浸润的基质/免疫细胞的存在。ESTIMATE算法基于单样本基因集富集分析生成三个评分:基质评分(捕获肿瘤组织中基质的存在)、免疫评分(表示免疫细胞在肿瘤组织中的浸润)、ESTIMATE评分(综合基质评分和免疫评分,推断肿瘤纯度)[6]。我们使用R软件包estimate(https://r-forge.r-project.org/projects/estimate/)计算高风险组和低风险组的基质评分、免疫评分、ESTIMATE评分以及重量纯度,并进行组间比较。
1.7 免疫浸润分析
通过CIBERSORT算法估计TCGA-LAML数据集中22种免疫细胞的浸润比例,模拟次数为1 000次[7]。基于R软件包corrplot(https://CRAN.R-project.org/package=corrplot)对预后基因或风险评分与免疫细胞含量进行相关性分析,以|r|>0.2且P<0.05为标准阈值,其中r为相关系数。
1.8 免疫检查点相关性分析和差异分析
收集47个常见的免疫检查点,分别为:IDO1、LAG3、CTLA4、TNFRSF9、ICOS、CD80、PDCD1LG2、TIGIT、CD70、TNFSF9、ICOSLG、KIR3DL1、CD86、PDCD1、LAIR1、TNFRSF8、TNFSF15、TNFRSF14、IDO2、CD276、CD40、TNFRSF4、TNFSF14、HHLA2、CD244、CD274、HAVCR2、CD27、BTLA、LGALS9、TMIGD2、CD28、CD48、TNFRSF25、CD40LG、ADORA2A、VTCN1、CD160、CD44、TNFSF18、TNFRSF18、BTNL2、C10orf54、CD200R1、TNFSF4、CD200、NRP1。首先,筛选出高风险组和低风险组间差异表达的免疫检查点,然后,进一步基于R软件包corrplot分析免疫检查点表达与风险评分的相关性,以|r|>0.3以及P<0.05为标准阈值进行筛选。
2.1 AML中55个免疫基因差异表达
通过GEO数据库得到AML患者和正常对照的骨髓样本的转录组RNA-seq数据集GSE15061,以P<0.05为阈值筛选出差异表达的基因,选取差异表达最为显著的前500个基因(图1a)。同时,从IMMPORT数据库中下载到1 793个免疫相关基因,取差异表达的基因与免疫相关基因的交集,获得AML患者中差异表达显著的55个免疫相关基因(图1b)。

图1 AML中差异表达的免疫基因的筛选Fig.1 Screening of differentially expressed immune genes in AML
2.2 免疫基因的预后风险模型构建
在TCGA数据库中下载AML的转录组RNA测序数据集TCGA-LAML,其中包含141例AML患者的骨髓样本以及临床信息。首选以上55个免疫基因进行单因素COX分析(以P<0.05为阈值),发现其中6个基因(FLT3、FGF13、CRLF3、GZMB、KLRD1、IGF2R)与AML患者的生存情况显著相关(图2a)。随后,通过多因素COX分析构建包含4个免疫基因(FGF13、GZMB、FLT3、CRLF3)的风险模型,根据以下公式计算每位患者的风险评分:风险评分=(-1.645 7×ExpFGF13)+(0.064 9×ExpGZMB)+(0.002 9×ExpFLT3)+(-0.064 6×ExpCRLF3),其中Exp表示基因表达。以风险评分中位数为分界线,将患者划分为高风险组和低风险组(图2b)。通过进一步对风险模型中AML患者的生存状态进行统计,结果发现,高风险组中死亡患者的数目要多于低风险组,并且其生存时间普遍更短(图2c)。4个免疫基因在低风险组与高风险组间也存在一定的差异表达(图2d)。

图2 基于TCGA-LAML数据集构建预后风险模型Fig.2 Construction of a prognostic risk model based on the TCGA-LAML dataset
2.3 由FGF13、GZMB、FLT3、CRLF3构建的风险模型可准确预测AML患者的预后
Kaplan-Meier生存曲线分析结果表明,低风险组患者的存活时间明显高于高风险组患者(图3a)。ROC分析结果也显示了风险模型1、2、3 年总生存率的良好预测准确性(图3b)。进一步分析该风险模型与AML患者临床参数的相关性,结果显示,高风险组和低风险组患者的性别无明显差异(图3c),高风险组患者的年龄显著高于低风险组(图3d)。绘制列线图展示了风险评分、年龄和性别对患者生存的预测能力,总得分可用于预测AML患者1、2、3年生存率(图3e),并绘制了1年生存率的校正曲线(图3f)。以上结果表明,由4个免疫基因(FGF13、GZMB、FLT3、CRLF3)构建的风险模型可准确预测AML患者的预后。

图3 风险模型在AML患者预后中的预测价值Fig.3 Predictive value of risk models in the prognosis of AML patients
2.4 风险模型与AML肿瘤微环境中免疫浸润密切相关
在肿瘤微环境中,免疫细胞和基质细胞是两种主要类型的非肿瘤组分,并且已被提出对于肿瘤的诊断和预后评估是有价值的。为了探究4个免疫基因构建的风险模型与AML肿瘤微环境是否相关,我们基于EATIMATE算法计算基质评分、免疫评分、ESTIMATE评分以及肿瘤纯度,评分越高说明细胞含量越高。结果表明:高风险组和低风险组基质评分无显著差异(图4a);
高风险组免疫评分显著高于低风险组(图4b);
高风险组综合评分显著高于低风险组(图4c);
高风险组肿瘤纯度显著高于低风险组(图4d)。这说明,由FGF13、GZMB、FLT3、CRLF3构建的风险模型与免疫浸润密切相关。

图4 高风险组和低风险组AML样本的肿瘤微环境分析Fig.4 Tumor microenvironment analysis of AML samples in high-risk group and low-risk group
2.5 风险模型与AML中免疫细胞的含量密切相关
前面结果显示,该风险模型与免疫浸润存在显著相关性。我们进一步通过CIBERSORT算法估计了TCGA-LAML数据集中22种免疫细胞的浸润比例,并分析了两组免疫细胞含量的差异。结果显示:高风险组中未激活的B细胞、CD8+T细胞、激活的自然杀伤细胞的含量显著高于低风险组,同时,以上免疫细胞的含量与风险评分显著正相关(图5a~5c、5e);
高风险组中未激活的CD4+T细胞、静息的肥大细胞的含量显著低于低风险组,同时,以上免疫细胞的含量与风险评分显著负相关(图5a、5d、5f)。

图5 基于CIBERSORT算法估计高风险组和低风险组免疫细胞含量Fig.5 Estimation of immune cell content in high-risk group and low-risk group based on CIBERSORT
2.6 风险模型与多个免疫检查点显著相关
本文分析了47个常见的免疫检查点在高风险组和低风险组的表达,其中15个免疫检查点的表达存在显著差异(图6a)。相关性分析结果显示,其中4个免疫检查点(CTLA4、PDCD1、KIR3DL、LAG3)与风险评分的相关性显著,且均为正相关(图6b~6f)。这也进一步体现了该风险模型在AML患者免疫治疗中的应用潜力。
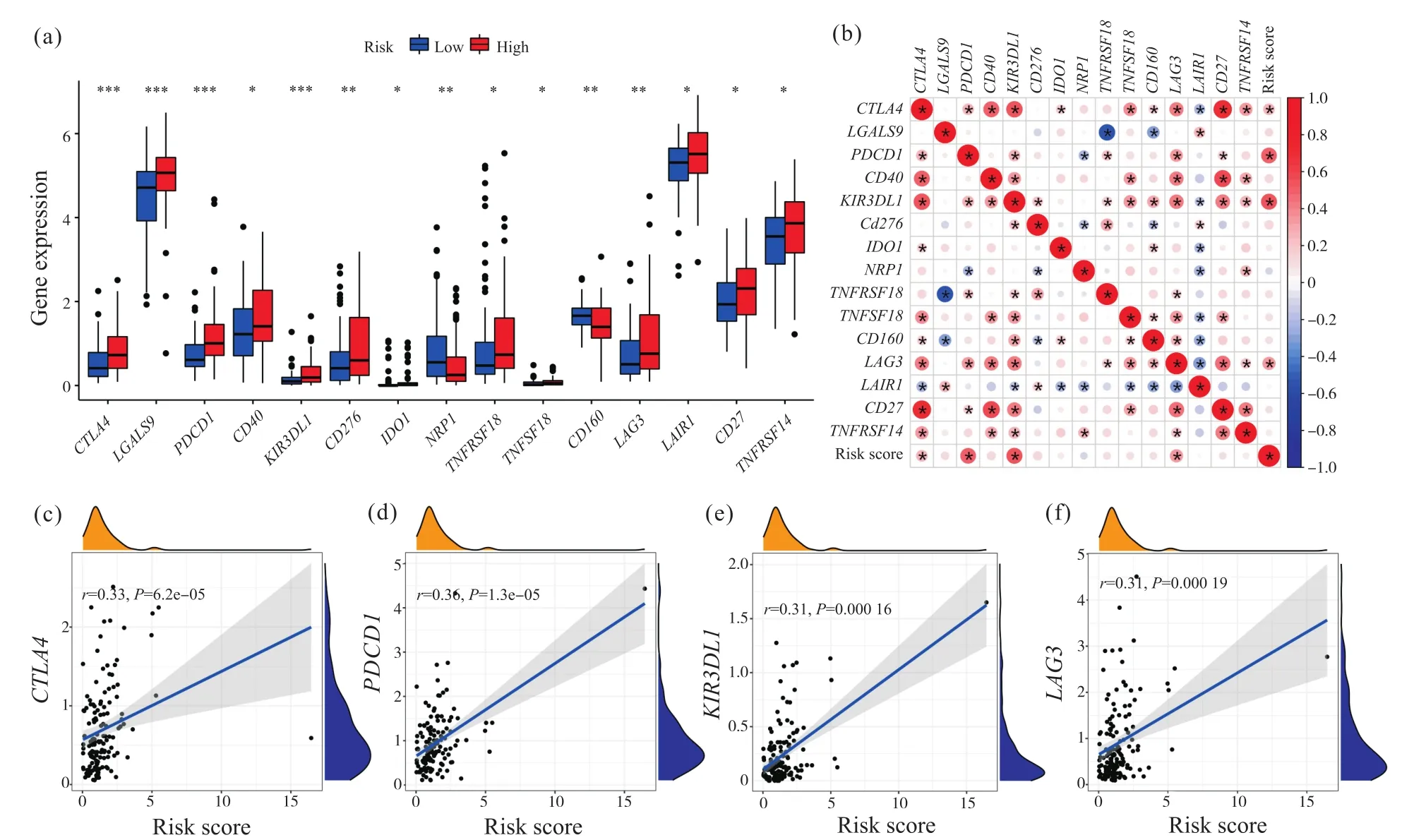
图6 风险模型与免疫检查点相关性分析Fig.6 Correlation analysis between risk model and immune checkpoint
2.7 FGF13、GZMB、FLT3、CRLF3与AML患者生存、免疫细胞含量显著相关
为了进一步探究风险模型中4个免疫基因(FGF13、GZMB、FLT3、CRLF3)与AML患者生存、免疫细胞含量的相关性。我们基于TCGA-LAML数据集,根据基因高/低表达进行分组。Kaplan-Meier生存曲线分析结果表明:高表达FGF13、CRLF3组患者的存活时间明显高于低表达组患者(图7a、7g);
高表达GZMB、FLT3组患者的存活时间明显低于低表达组患者(图7c、7e)。免疫细胞的含量差异分析结果表明:高表达和低表达FGF13组间静息的CD4+记忆T细胞、单核细胞、M2巨噬细胞、静息的肥大细胞含量存在显著差异(图7b);
高表达和低表达GZMB组间未激活的B细胞、浆细胞、CD8+T细胞、激活的CD4+T细胞、静息的自然杀伤细胞、静息的树突状细胞、静息的肥大细胞、嗜酸性粒细胞的含量存在显著差异(图7d);
高表达和低表达CRLF3组间γδ T细胞、M2巨噬细胞、嗜酸性粒细胞、中性白细胞含量存在显著差异(图7h);
高表达和低表达CRLF3组间静息的CD4+T细胞、激活的自然杀伤细胞含量存在显著差异(图7f)。
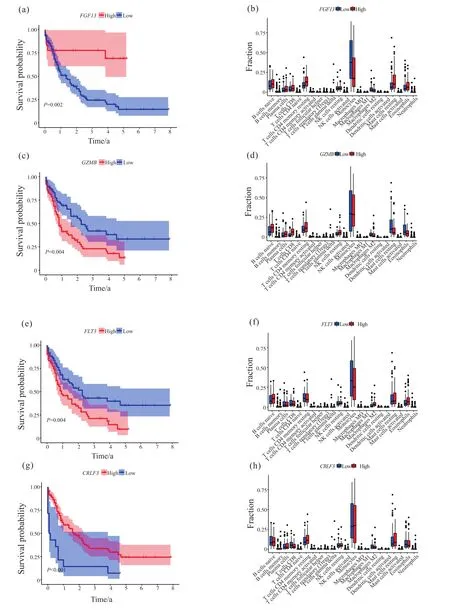
图7 FGF13、GZMB、FLT3、CRLF3与AML患者生存、免疫细胞含量的相关性Fig.7 Correlation between FGF13, GZMB, FLT3, CRLF3 and survival and immune cell content in AML patients
AML作为一种侵袭性的血液恶性肿瘤,疾病进展快速且预后较差,目前认为这与骨髓微环境相关[8]。骨髓微环境是由免疫细胞、基质细胞、细胞外基质以及细胞因子等一起构成的动态系统。其中,基质细胞和免疫细胞是AML发生发展所必需的主要成分[9]。AML的骨髓微环境在患者治疗和预后中发挥着极其重要的作用,然而,其中相关细胞及分子在AML预后中的作用并不清楚[10]。本研究基于141例TCGA-LAML样本,通过EATIMATE算法计算高风险组和低风险组的基质评分、免疫评分、ESTIMATE评分以及肿瘤纯度,结果显示,免疫细胞浸润可能在AML肿瘤微环境中发挥了重要作用。鉴于AML患者骨髓微环境的免疫特征仍然不是很清楚,我们有必要对于骨髓微环境中免疫细胞浸润模式进行进一步的探究,筛选免疫相关预后基因,建立准确性良好的预后风险模型,并为AML患者个体化治疗提供重要的参考价值。
目前尚缺乏免疫基因相关AML预后评估模型。本研究首次提出4个重要的免疫基因(FGF13、GZMB、FLT3、CRLF3)构建的风险评估模型可准确预测AML患者的预后,其中,FGF13、CRLF3为低风险基因,GZMB、FLT3为高风险基因。研究发现,FGF13在多种肿瘤中均发挥了一定的功能[11-12],其中,FGF13与肝细胞癌微环境中免疫细胞浸润密切相关[13]。GZMB编辑的蛋白可由自然杀伤细胞和细胞毒性T淋巴细胞分泌,被认为是一种细胞毒性的促凋亡蛋白酶[14]。值得一提的是,GZMB在乳腺癌等肿瘤免疫浸润中具有一定的功能[15]。本研究也发现,与低表达GZMB组相比,高表达GZMB组CD8+T细胞、静息的自然杀伤细胞等的含量显著升高,静息的肥大细胞、嗜酸性粒细胞等的含量显著降低。目前已有较多的研究表明,FLT3与AML发生发展存在关联[16-17],并在临床治疗上展现了一定的价值[18]。如Patnaik等[16]发现,FLT3-ITD是一个负面的预后因素,即使在化疗或干细胞移植后仍具有预后相关性,这也与本研究结果一致。CRLF3在血小板形成的最后阶段发挥了关键作用,是血小板血症潜在的治疗靶点[19]。虽然暂无研究显示CRLF3与骨髓微环境存在关联,但有证据表明,CRLF3在改善AML患者预后中可能存在一定的价值[20]。此外,本研究单基因预后分析结果也显示,FGF13、GZMB、FLT3、CRLF3与AML预后显著相关,同时与骨髓微环境中多种免疫细胞的含量密切相关。各免疫基因发挥作用的具体机制亟待进一步探究。
越来越多的研究显示,肿瘤浸润性免疫细胞在预测肿瘤治疗和预后效果中发挥了重要作用,部分免疫细胞亚群的作用尤为突出[21-22]。基于去卷积原理的CIBERSORT算法可以利用标准化的基因表达数据去计算不同免疫细胞亚群的相对比例,进而量化特定细胞类型的丰度,在一定程度上克服了传统分析方法的缺陷[23],目前已应用于多种肿瘤中[24-25]。本研究采用CIBERSORT算法估计AML骨髓样本中22种免疫细胞的分布比例,并依据风险评分将样本分为高风险组和低风险组,同时比较组间免疫细胞含量的差异。在过去的十年里,免疫治疗在肿瘤治疗方面取得了巨大的进步,实现肿瘤免疫治疗的一个极有希望的方法是阻断免疫检查点途径[26]。本研究构建的预后风险模型与4个免疫检查点(CTLA4、PDCD1、KIR3DL、LAG3)显著相关。结合研究表明,以上免疫检查点已在临床上应用广泛[27-28]。这也进一步明确了该免疫相关的风险模型在AML免疫治疗中的应用潜力。
综上所述,本研究依据多种数据库,通过生物信息学构建了包含4个免疫相关基因(FGF13、GZMB、FLT3、CRLF3)的预后风险模型。该模型与免疫细胞以及CTLA4等免疫检查点密切相关,同时可预测AML患者的预后。需说明的是,本研究的结论是基于公共数据库数据以及生物信息学分析所得,仍有待开展相关体内外试验加以验证,这也是本项目组今后工作的重点。本研究为探究免疫相关基因在AML骨髓微环境中的作用机制提供了生物信息学证据,为后续改善AML治疗和预后提供了新的靶点,具有较好的理论指导价值。
猜你喜欢 检查点高风险基因 Spark效用感知的检查点缓存并行清理策略①计算机系统应用(2022年4期)2022-05-10上海市高风险移动放射源在线监控系统设计及应用核安全(2022年2期)2022-05-05Frog whisperer疯狂英语·新读写(2021年10期)2021-12-07免疫检查点抑制剂相关内分泌代谢疾病天津医科大学学报(2021年4期)2021-08-21高风险富水隧道施工技术经济分析铁道建筑技术(2021年4期)2021-07-21修改基因吉凶未卜奥秘(2019年8期)2019-08-28创新基因让招行赢在未来商周刊(2017年7期)2017-08-22高风险测试对英语学习的反拨效应研究北方文学·下旬(2017年4期)2017-05-21分层检查点的近似最优周期计算模型计算机应用(2017年1期)2017-04-17基因小猕猴智力画刊(2016年6期)2016-05-14猜你喜欢
- 2024-01-20 有关于第五次全国经济普查统计重点业务综合培训大会上讲话(完整文档)
- 2024-01-20 “严纪律、转作风、保安全、树形象”专题学习教育活动通知(完整文档)
- 2024-01-20 2024XX区住房城乡建设工作情况汇报
- 2024-01-20 2024高校思政教育交流材料:善用反腐败斗争这堂“大思政课”(精选文档)
- 2024-01-20 2024年主题教育专题党课辅导报告,(4)
- 2024-01-20 关于赴某地学习考察地方立法工作情况报告(范文推荐)
- 2024-01-20 2024年度关于增强党建带团建工作实效对策与建议(精选文档)
- 2024-01-20 教师演讲稿:春风化雨育桃李,,潜心耕耘满芬芳(全文)
- 2024-01-20 主题教育第二阶段来了
- 2024-01-20 2024年度关于到信访局实践锻炼个人总结【完整版】
- 搜索
-
- 打赌输了任人处理作文1000字7篇 05-12
- 当代大学生在全面建设社会主义现代化强 05-12
- 全面建成社会主义现代化强国的战略安排 03-10
- 个人廉洁自律方面存在的问题及整改措施 05-12
- 谈谈青年大学生在中国式现代化征程上的 05-12
- 2022年党支部第一议题会议记录(全文完 11-02
- 作为青年大学生如何肩负时代责任6篇 05-12
- 村党组织建设现状及工作亮点存在问题与 05-12
- 全面从严治党,自我革命重要论述研讨会 05-12
- 产业工人队伍建设改革(全文完整) 10-31
- 11-25国庆70周年庆典晚会 庆典晚会串词
- 11-25办公室礼仪的十大原则 浅谈办公室的电话礼仪
- 01-17用心灵轻轻地歌唱_心灵的歌唱
- 01-17也许你不是我一生的唯一|也许不是我
- 01-17爱了,请珍惜;不爱,趁早放手|爱就珍惜不爱就放手
- 01-17岁月带走的是记忆,但回忆会越来越清晰|有趣又有深意的句子
- 01-17曾经的美好只是曾经,我只想珍惜身边的人|我只想珍惜你
- 01-18从容不惊 [学会笑眼去看世界,不惊不乍,淡定从容]
- 02-03当代大学生学习态度调查报告
- 02-03常用护患英语会话
- 标签列表
