首页 > 心得体会 > 学习材料 / 正文
CO2电化学还原制CO金属催化剂的研究进展
2023-03-09 20:25:08 ℃范琳,杨磊,车晓甄,李夺,潘立卫,钟和香
CO2电化学还原制CO金属催化剂的研究进展
范琳,杨磊,车晓甄,李夺,潘立卫,钟和香
(大连大学环境与化学工程学院,辽宁 大连 116622)
利用可再生能源CO2电化学还原制CO是实现“碳中和”目标及可再生能源储存的有效途径之一。简述了CO2电化学还原的优势及基本反应原理,综述了近年来水溶液中CO2电化学还原制CO金属电催化剂的研究进展。从制备纳米粒子并调控其组成和结构、构筑合金、设计金属中心和配体与载体的结构以及开发单原子催化剂等方面,重点讨论了单金属纳米催化剂、双金属催化剂、金属有机络合物催化剂和单原子催化剂对CO2电化学还原制CO性能的影响及相关反应机理,总结了各类催化剂的优缺点,对CO2电化学还原制CO金属催化剂的发展方向进行了展望。
二氧化碳;
电化学还原;
一氧化碳;
电催化剂

目前,CO2主要通过化学转化、生物转化、光化学还原和电化学还原(ERC)等方法转化。化学转化法通常在高温高压的条件下进行,存在反应能耗高等问题;
生物转化法存在催化剂成本高、寿命短和产率低的问题;
光化学还原法体系复杂,反应效率低。相较于以上转化方法,ERC法具有以下优势:反应可以在常温、常压条件下进行,能耗较低;
可以将CO2转化为高附加值化学品。然而,ERC仍存在一些挑战,如目标产物的选择性较低、反应过电位高、能量利用率低等。因此,提高化学还原CO2产物的选择性、降低反应的过电位是ERC研究的主要方向。CO是工业生产过程中的一种重要燃料及化工原料,可用于合成高附加值的化合物,如酸、酯、醇和金属羰基化合物[5];
以合成气(CO与H2的混合物)为原料,通过费托合成反应可以制备液态碳氢化合物[6⁃7]。本文在简要介绍ERC反应原理的同时,对ERC制CO的单金属纳米催化剂、双金属催化剂、金属有机络合物催化剂和单原子催化剂的研究进展,以及各类催化剂的特点和性能进行了归纳总结,并对其未来进行了展望。

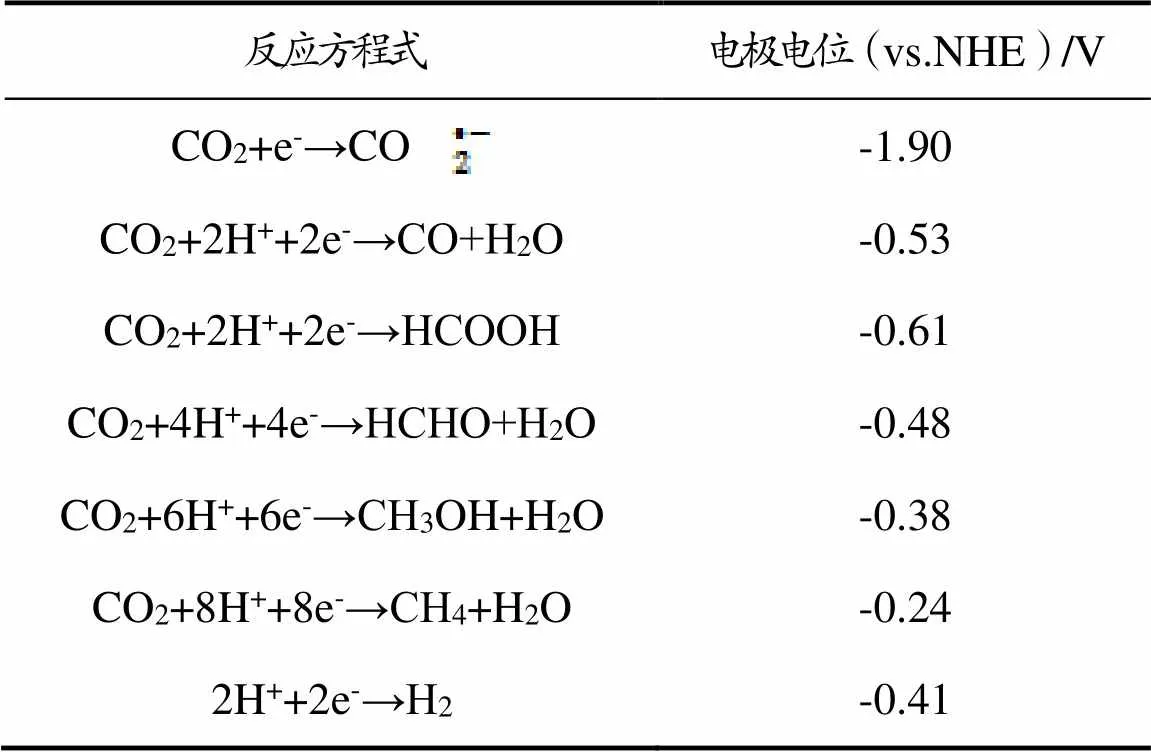
表1 ERC阴极反应及对应的标准电极电位
图1为CO2电催化还原制CO示意图[14]。由图1可知,ERC制CO是一个双电子转移过程。CO2分子与质子反应得到*COOH,随后*COOH得到一个质子和电子生成吸附态的*CO,*CO进而脱附生成CO。在生成CO的反应过程中,*COOH中间体加氢形成*CO中间体的过程是一个重要的控速步骤。
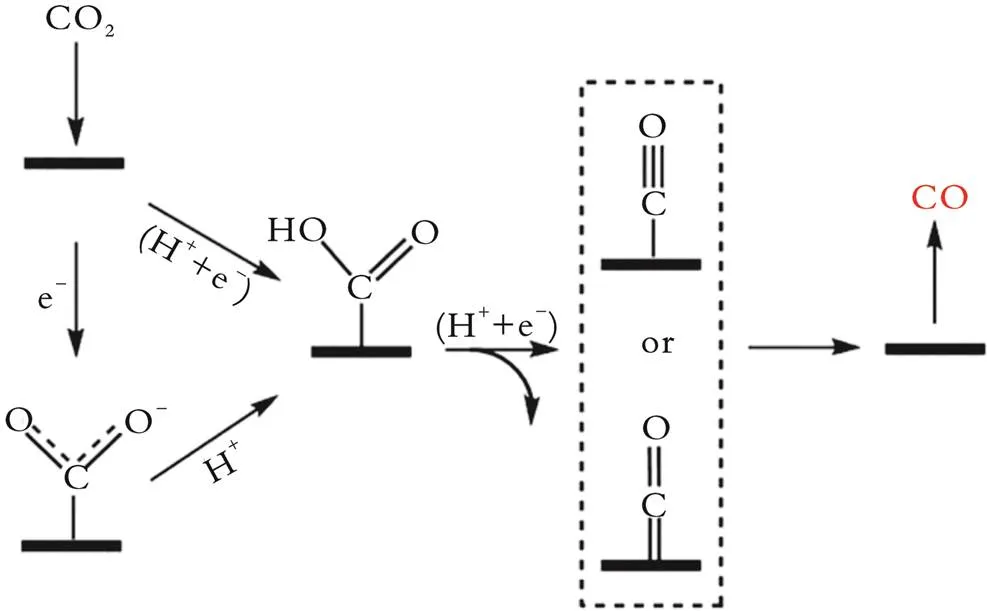
图1 CO2电催化还原制CO示意图
根据该反应途径,ERC制CO的高效催化剂对主要中间体*COOH应具有较高的活化能;
从有利于CO脱附的角度考虑,ERC制CO的高效催化剂与*CO应具有较弱的结合能力。高效催化剂可减少电子能量的输入,降低ERC反应的过电位,同时提高目标产物的选择性。因此,设计并合成新型催化剂是实现ERC制CO的关键。
在ERC制CO的反应中,金属催化剂因具有良好的导电性和高选择性受到越来越多的关注[15⁃16]。与*CO结合能力较弱的金属主要有Au、Ag和Zn。其中,Zn非贵金属存在难以同时获得高电流密度(CO)和高选择性的问题;
Au、Ag金属具有较好的稳定性和催化活性,但价格昂贵,限制了其大规模应用。对金属催化剂进行结构调控,可以提高其催化活性及选择性,降低ERC反应的过电位。近年来,研究人员通过不同结构单金属纳米催化剂的研制及结构调控、构筑合金催化剂、调控金属有机络合物催化剂的活性中心和配体及载体的结构、开发单原子催化剂等策略,来调控催化剂对反应中间体的吸脱附状态及结合力,从而提升其ERC性能。
2.1 单金属纳米催化剂
由于材料的固有性质,ERC产物的选择性主要取决于催化剂的结构和组成。与块状金属相比,纳米催化剂可为ERC提供较高的比表面积和较多的活性位点,因此具有更好的ERC性能[17]。金属纳米催化剂的粒径、结构和形貌对ERC效率和产物分布具有非常重要的影响。表2为单金属纳米催化剂ERC制CO性能对比。

表2 单金属纳米催化剂ERC制CO性能对比
金属纳米催化剂的粒径对ERC制CO的选择性和催化活性具有很大的影响。D.Gao等[18]发现,钯纳米颗粒(Pd NPs)对ERC的选择性和活性有较大的影响;
在电位(vs.RHE)为-0.89 V的条件下,当Pd NPs的粒径从10.3 nm减小到3.7 nm时,CO增加了18.4倍,法拉第效率(CO)从5.8%上升到91.2%。H.Mistry等[19]合成了粒径为1.0~8.0 nm的Au NPs。实验结果表明,随着Au NPs粒径的减小,CO急剧增加,但CO的选择性降低。综上可知,通过减小纳米颗粒的粒径,可以提高催化剂的活性比表面积,增加活性位数量。但是,由于析氢等竞争反应的存在,活性位数量不是影响催化剂CO的唯一因素,不同活性原子的比例和分布也是影响ERC制CO的活性和选择性的因素。随着金属催化剂粒径的减小,低配位原子逐步暴露且其比例逐渐升高。低配位数活性位点,例如边缘位点有利于生成CO,而角位点更容易生成H2[19]。
调整催化剂的晶面结构也是提高ERC性能的主要途径。在ERC过程中,金属催化剂的活性和选择性不仅与其比表面积有关,而且还与表面结构密切相关。D.R.Yang等[20]对比了粒径为50.0 nm的金胶体和金二十四面体(Au TOH)对CO的选择性。结果表明,在电位为-0.60 V时,Au TOH的最大CO为88.8%,是金胶体最大CO的1.5倍;
Au TOH的(221)面形成*COOH的势垒低于金胶体(111)面的势垒,具有高CO选择性和低过电位。
S.Liu等[21]制备了完全被(100)面包围、粒径为25 nm的银纳米立方体(L25‐Ag‐NCs)。结果表明,CO接近于100.0%;
在Ag(100)和边缘位点上形成*COOH和*CO所需的能垒显著低于Ag(111)上的能垒,因此这些活性位点具有更高的催化活性和更低的起始电位;
与粒径为70 nm的L70⁃Ag⁃NCs相比,L25‐Ag‐NCs具有更高的(100)晶面比例,因而具有更高的活性和选择性,这说明(100)晶面更有利于CO的生成。H.Dong等[22]发现,与(100)面包围的Pd立方体和(111)面包围的Pd八面体相比,由高指数(310)面包围的Pd凹面立方体CO高,其值为90.6%;
凹立方体的(310)面可通过促进*COOH的形成和*CO的解吸来提高催化活性。综上可知,表面原子排布和密度不同的晶面,具有不同的表面低配位数原子和表面边缘活性位等特殊结构,可以为催化剂提供更多的反应活性位点。因此,通过调控纳米颗粒的活性位种类及高指数晶面,可精确合成特定的纳米结构,最大限度地引入ERC制CO有利的活性位点,从而提高催化剂的ERC性能。不同金属的优势晶面不同,对哪种晶面更有利于ERC反应中CO的生成还没有定论,晶面结构和催化性能的关系仍需进一步研究。
此外,暴露更多催化活性位点的三维纳米电极也被用于CO2电催化还原。T.Fan等[24]制备了具有三维多孔结构和较大比表面积的海绵状多孔Ag纳米立方体(SPC‐Ag)。结果表明,SPC‐Ag具有丰富的活性位点并可降低阻抗,加速ERC的动力学速度;
在电位为-0.90 V时,SPC⁃Ag的CO为93.0%,远高于商业纳米颗粒Ag。Y.Lu等[25]合成了多孔网状Zn催化剂。结果表明,在电位为-1.10 V时,CO的最大值为77.9%,是Zn箔对应数值的2.0倍。Y.H.Li等[26]开发了一种具有尖锐尖端的Zn纳米线(w⁃Zn)并应用于ERC。结果表明,在电位为-0.95 V时,CO最大值约为98.0%,且在35 h内仍能保持稳定性。三维纳米电极通常具有大的活性比表面积及较多的活性位点,含有大量的低配位电子,可以显著提高ERC制CO的活性。同时,三维结构具有足够多的孔隙,有利于CO2的吸附和电解液的浸润,实现快速传质,加快反应速度。
对于单金属催化剂,催化剂的粒径、晶面、活性位点种类等可以调控催化剂的活性和选择性。CO的选择性高度依赖催化剂表面对反应中间体(如*CO和*COOH)的结合能力。在制备单金属纳米催化剂的过程中,通过控制纳米粒子粒径及调控催化剂的结构和形貌、改变活性位点的种类和比例,可以调节其对中间体的结合强度,提高催化性能。单金属催化剂之所以具有高ERC催化活性,是因为金属纳米粒子提供的高比表面积、大量的活性位点和适当的边缘与角位点的比例,因而有利于*COOH的形成和*CO的脱附。但是,单金属纳米催化剂存在过电位高、CO低及稳定性不佳的问题,进一步提升该催化剂的性能是下一步研究的重点。此外,对纳米单金属催化剂的构⁃效关系仍不清楚,粒径、晶面、活性位点种类等是决定其活性和选择性的主要因素,仍然存在争议。活性位点不能定量测试,因此需要结合DFT计算和原位表征技术,解析催化剂表面ERC催化机理,解析活性位点数量和种类对催化剂选择性和活性的影响。此外,精确控制催化剂的合成方法和条件,以获得不同比例的活性位点,从而提高单金属催化剂性能也是研究的重点。
2.2 双金属催化剂
单金属纳米催化剂存在过电位高、CO低等问题,双金属催化剂通过结合两种金属来改变催化剂催化性能,以克服单一金属的ERC催化性能的局限性。通过调节电极表面的化学环境,可减小CO2与中间产物之间的能量差,为相应的反应提供较低的过电位[27]。通过精细调控双金属催化剂组成和结构,可以在降低成本的同时获得比单金属催化剂更优越的性能[28⁃29]。双金属催化剂ERC制CO性能对比如表3所示。
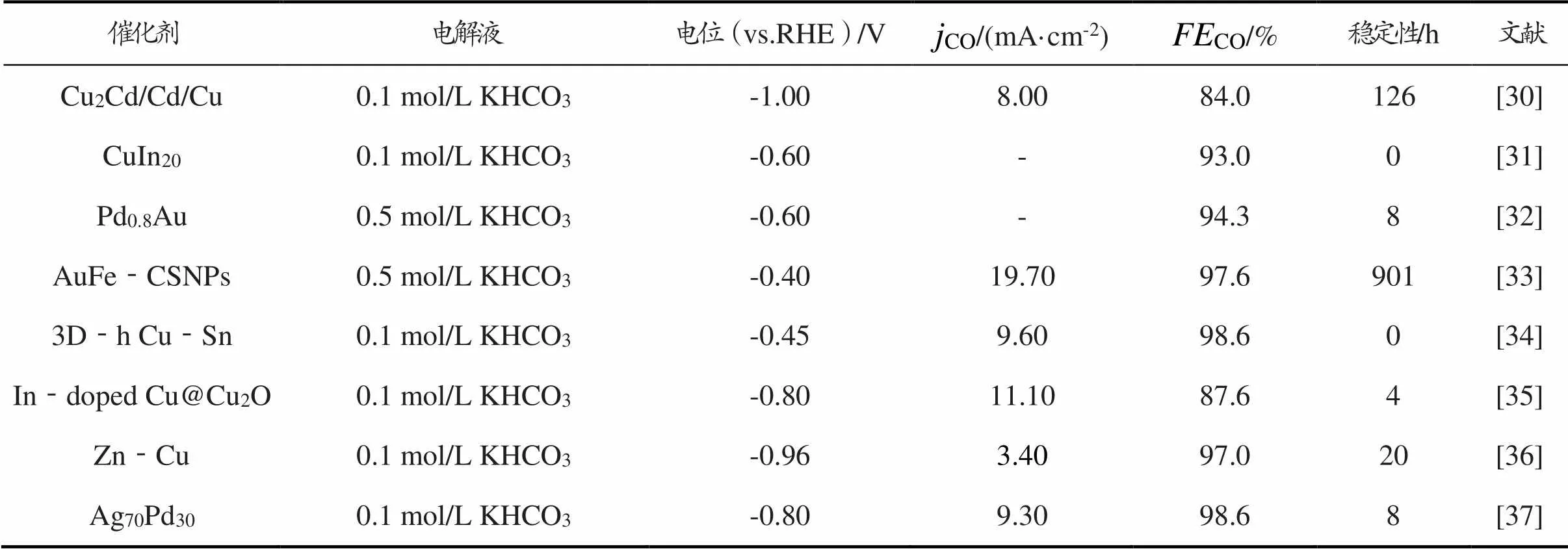
表3 双金属催化剂ERC制CO性能对比
双金属催化剂通过暴露丰富的催化活性位点来有效固定关键的还原中间产物,提升ERC活性;
双金属催化剂通过与其他金属结合提供反应中间体的多个结合活性位点,调节反应中间体与催化剂表面的结合强度;
双金属催化剂是合成高性能催化剂的重要策略,其中金属原子相互作用可诱导几何效应或电子效应,改变表面吸附性质并提高活性。C.Wang等[30]设计了Cu2Cd/Cd/Cu双金属催化剂并用于ERC。结果表明,该催化剂在电位为-1.00 V时CO为84.0%。这是因为Cu和Cd的结合形成了丰富的边界,为ERC提供了足够的活性中心,Cu2Cd提高了催化剂和*COOH之间的结合能。与Cu NWs相比,W.Luo等[31]合成的Cu‐In催化剂ERC性能有所提高,稳定性为60 h。这是因为高密度的金属In纳米颗粒沉积在Cu NWs表面,提供了丰富的Cu‐In界面,Cu、In两种金属界面显著降低了ERC关键反应中间体*COOH的自由能势垒;
弱吸附*H和强吸附*OCHO抑制了生成竞争性产物H2和HCOOH反应的活性。双金属催化剂利用不同金属的电子亲和性来吸附氧原子和碳原子,在确定中间体(例如*COOH和*OCHO)与金属的结合能方面起着关键作用。
通过合理设计合金结构(例如形成核壳结构),可以调控金属界面电子结构,进而优化双金属催化剂的选择性和稳定性。S.Zhu等[32]开发了由纯Pd原子薄壳和Pd‐Au核组成的具有核壳结构和富晶界结构的扭曲Pd‐Au纳米线。结果表明,与纳米粒子相比,富晶界和缺陷的纳米线表面更容易生成CO;
Au与Pd的结合显著提高了线式吸附CO与桥式键合CO的比例,使其更容易从Pd壳中解吸,从而提高反应速率。K.Sun等[33]利用溶剂热合成法制备了Au/Fe合金纳米粒子。结果表明,在ERC反应过程中,Au/Fe合金纳米粒子表面的Fe发生溶解,Au在粒子表面重新排列,形成以Au为外壳、AuFe合金为核心的核壳结构纳米粒子(见图2),在电位为-0.40 V时的CO高达97.6%;
运行90 h后,AuFe‐CSNPs的CO仍然稳定在19.70 mA/cm2;
在Fe浸出前后,Au‐Fe合金的成分和形态没有发生明显的变化;
AuFe‐CSNPs表面Fe的浸出使Au表面层中存在大量空位缺陷,导致表面呈锯齿状核壳结构的形成,次外层的Fe可以稳定Au壳层的缺陷,使AuFe‐CSNPs具有良好的稳定性。
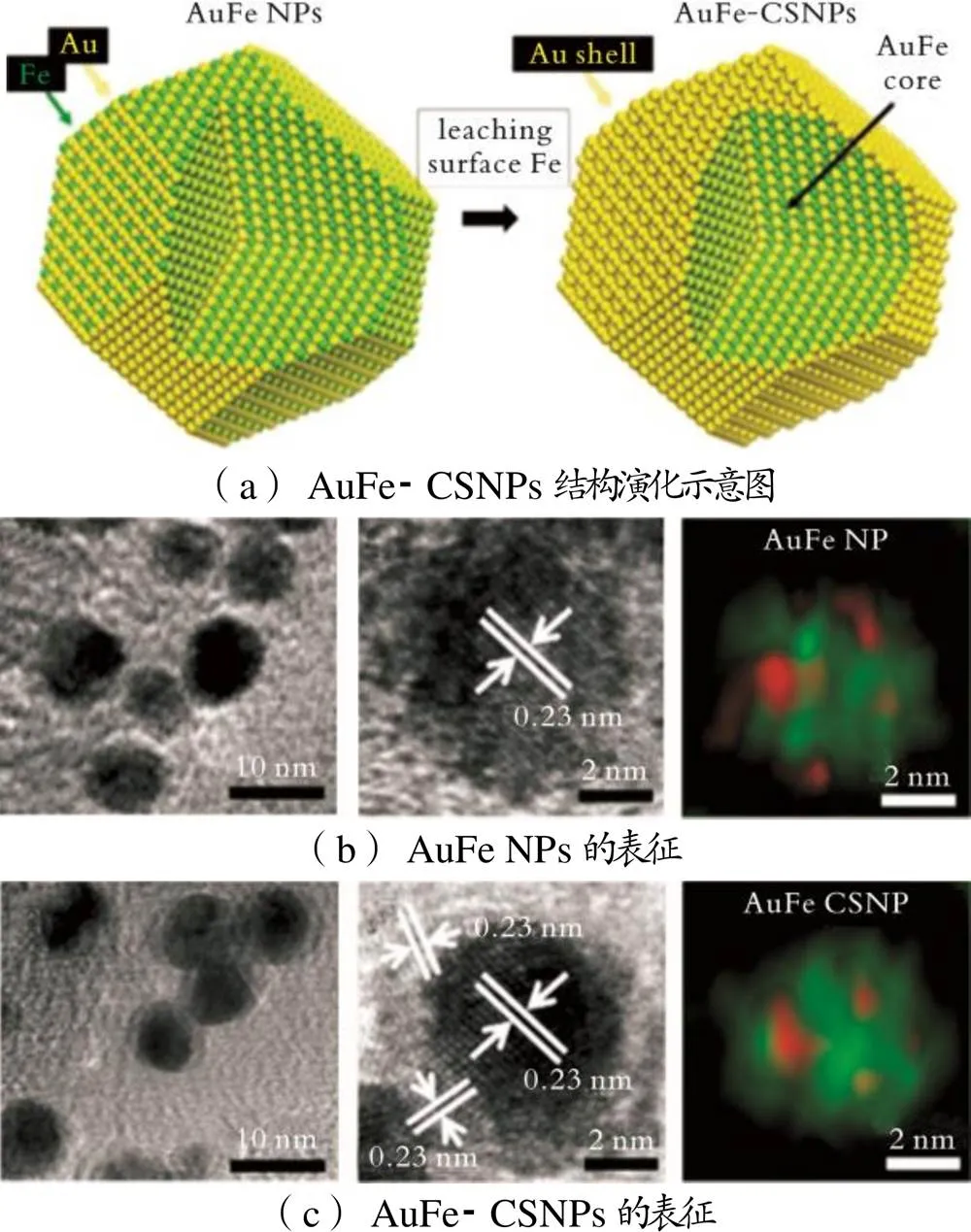
图2 AuFe⁃CSNPs结构演化示意图及其结构表征
核壳结构可以通过调整催化剂表面电子分布来改变金属与CO2还原中间体的结合强度;
通过改变活性位点的局部原子排列,进而影响对不同中间体的选择性吸附。核壳结构的壳层可以很好地保护内部活性位,阻止活性位的损失和聚集,以提高催化剂的稳定性,核壳组分之间的相互作用可以提升催化剂的活性和选择性。核壳结构可以是两种金属,也可以是金属⁃金属氧化物异质结构,均可以对ERC表现出优异的性能。但是,随着ERC过程中化学环境的变化,核壳结构催化剂表面原子发生重排,由核壳结构转变成合金,从而影响催化剂长期运行过程中的稳定性、活性和选择性。因此,设计并构筑核壳结构催化剂并提高其结构稳定性是保证其实用性的关键。此外,核壳结构合成过程相对合金复杂,因此开发简单、廉价的合成方法也是推进其实际应用的关键。

总之,引入第二种元素调控金属催化剂的组成、结构和电子排布,能够有效调节反应中间体的活化能势垒和吸附强度,引导目标产物的生成。但是,在双金属材料合成中,催化剂的结构及组成很难做到精准控制,因此纳米晶体的成核和生长机制的研究是设计双金属催化剂的关键,实现双金属材料的精确控制以提高其催化活性是研究的重点。
2.3 金属有机络合物催化剂
在ERC中金属材料的研究最为广泛,但普通金属电极存在电流效率较低、稳定性不佳等缺点[38]。金属有机络合物是一类很有吸引力的材料[39⁃40],具有化学稳定性好和分子水平结构可调等显著优点。表4为金属有机络合物催化剂ERC制CO性能对比。
金属有机络合物催化剂分子间强大的相互作用使其存在极易堆叠的问题,影响活性位点的暴露,因此制备高度分散的异相催化剂成为难点。碳纳米材料,尤其是碳纳米管,因其与有机分子催化剂强的π-π相互作用而具有更大的表面积和更高的电子导电性[40],常被用来提高金属有机络合物催化剂的CO、CO和ERC稳定性。Z.Jiang等[41]研究了一系列用于ERC的金属酞菁催化剂MePc(Me代表Co、Fe和Mn)和CNT形成的杂化材料。结果表明,MePc分子锚定在碳纳米管上形成杂化材料,没有明显的分子聚集;
直接负载在电极上的MePc,其催化性能会被分子聚集所影响;
所有杂化物都表现出比直接负载在电极上的相应分子更高的活性和稳定性。M.Zhu等[42]设计了一种以吡啶功能化碳纳米管(CoPc⁃py⁃CNT)为载体的酞菁钴基催化剂。结果表明,吡啶基团通过与Co的轴向配位,可以作为物理促进剂来改善酞菁钴的分散性。J.Choi等[43]通过静电相互作用和π-π堆积制备了一种Fe(III)卟啉/石墨烯框架(FePGF)。结果表明,在过电位为480.00 mV时CO选择性高达97.0%;
石墨烯骨架的形成增强了电子转移,骨架内的Fe卟啉通过Fe中心之间的推拉机制稳定了CO2;
由层状石墨烯形成的高度多孔骨架结构促进了FePGF和电解质之间的接触面积,促进了CO2的传质。
CNT、石墨烯载体及多孔碳材料均可以作为有机化合物的载体,对ERC产生很大影响。将催化剂分子分散锚定在载体上,可减少催化剂的聚集,增加可接触活性位点,使电极具有很好的物质传输效应,为调控ERC催化剂性能提供一种途径。载体的孔结构、导电性、比表面积均可以影响催化剂的性能。因此,选择具有适宜结构的载体,是金属有机络合物催化剂研究的重点。
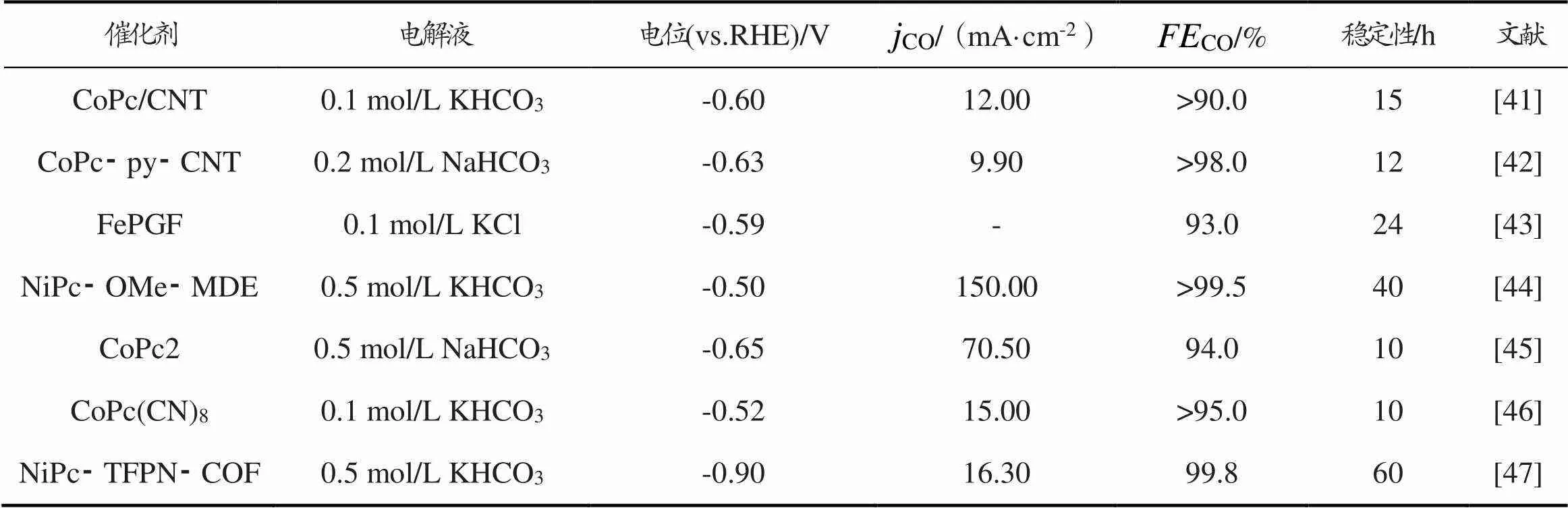
表4 金属有机络合物催化剂ERC制CO性能对比
金属有机络合物催化剂的金属中心和配体通常是调节电子结构和催化活性的主要手段。X.Zhang等[44]探索了NiPc的侧基功能化作用。结果表明,相较于吸电子氰基取代的NiPc(NiPc‐CN)催化剂,供电子甲氧基取代的NiPc(NiPc‐OMe)具有更高的ERC活性和选择性;
DFT计算表明,与吸电子CN基团相比,给予电子的OMe基团增强了Ni⁃N4位点的Ni⁃N强度,加速了CO的脱附,从而提高了催化剂的稳定性;
OMe取代稳定了*COOH中间体,进一步提高了ERC的选择性。M.Wang等[45]在CoPc母体上引入一个三甲基铵基和三个叔丁基制备了CoPc2催化剂。结果表明,CoPc2是一种比未取代酞菁CoPc1更好的催化剂,具有更高的CO选择性和活性,在相同过电位下CO增加约25.0%。X.Zhang等[46]报道了具有8个氰基取代基的菁钴(CoPc(CN)8),通过促进Co(I)活性位点的形成和CO的解吸,表现出比CoPc更高的活性和对CO的选择性。Y.Q.Lan等[47]设计了一系列金属酞菁共价框架催化剂(MPc⁃TFPN⁃COF,M代表Ni、Co、Zn)。结果表明,MPc⁃TFPN⁃COF具有高度均匀分散的单金属位,这些位点在酞菁的中心配位;
在电位为-0.90 V时,NiPc⁃TFPN⁃COF的CO可达到99.8%±1.24%,CoPc⁃TFPN⁃COF的CO可达到96.1%±1.25%,而ZnPc⁃TFPN⁃COF的CO仅有22.9%。对于金属有机络合物催化剂,金属中心和配体对ERC制CO性能具有重要影响。
金属有机络合物具有结构可调性,可以调控活性基团与关键中间体之间的相互作用,从而优化催化剂的ERC性能,其ERC活性通常与其金属中心密切相关。在驱动ERC所需的还原电位下,金属中心可能不稳定,从而形成金属纳米团簇或金属活性中心。将金属络合物负载在碳基底上可以减少分子的聚集,同时π-π相互作用或表面限域可能会限制金属络合物与基质间的电子转移,因此合理设计金属有机络合物催化剂的金属中心、配体与载体的结构仍是提高其催化活性和选择性的关键。目前,金属有机络合物催化剂存在CO较低、过电位高且在长时间电解过程中结构发生变化导致其失活的问题。因此,通过担载、改性等方法及构建三维立体结构电极,引入侧基调控催化剂电子结构,从而提高CO是此类催化剂的研究重点。通过修饰、改性等方法调控催化剂的活性位点,阻碍其活性位点的破坏和流失是提高其稳定性的主要策略。此外,金属有机络合物制备成本较高,开发新的合成方法,降低其成本是实现其广泛应用的有效手段。
2.4 单原子催化剂
原子级分散的金属催化剂由于原子利用率高和配位环境可调节而受到越来越多的关注。具有孤立金属位点的单原子电催化剂(SACs)表现出独特的配位环境和电子性质及优异的ERC活性。SACs具有单原子分散的活性金属中心,在多个催化反应中表现出最大的原子效率和优异的选择性[48⁃49]。在多相催化中,将金属纳米颗粒的粒径减小到单个原子的状态,可以显著地提高催化剂的原子利用率。Z.Li等[50]在氮掺杂碳上负载了从单个原子到Ni金属粒径超过100.0 nm的Ni金属催化剂。结果表明,ERC性能随Ni金属粒径的增加而减小,Ni单原子在电位为-0.80 V时的CO约为97.0%,而粒径为4.1 nm的Ni纳米粒子的CO约为93.0%,表明粒径较小的样品可以实现更高的原子利用效率。表5为单原子催化剂ERC制CO性能对比。

表5 单原子催化剂ERC制CO性能对比
目前,很多SACs均表现出较好的ERC制CO性能[58],其中Fe[55]、Co[59]和Ni[60]催化剂表现出与Au和Ag催化剂相当的CO,然而这些SACs的CO仍低于贵金属催化剂。为了获得与贵金属催化剂相等的CO,往往需要更大的过电位。针对这一挑战,J.Gu等[51]制备了一种分散的单原子Fe位点组成的催化剂(Fe3+‐N‐C),并进行了表征。结果表明,在过电位为80.00 mV下即可产生CO,在340.00 mV的高过电位下,CO最高为94.00 mA/cm2;
活性位点是与吡咯氮原子配位的单分散Fe3+,比传统的Fe2+位点具有更弱的O结合能力[56],因而具有ERC的高活性;
吡咯N原子对Fe3+有很大的影响,Fe氧化态的不同可能是由于配位环境的不同造成的,从而影响其ERC性能。该方法对SACs活性的调控提供了新的方向。
为了突破SACs难以同时获得高CO和高CO的限制,C.C.Yan等[53]在多孔碳中构建了配位不饱和Ni‐N活性中心来促进ERC,其中单原子Ni质量分数高达5.44%。结果表明,在电位为-1.03 V时,CO达到(71.50±2.90) mA/cm2,同时在-0.53~-1.03 V的宽电位下保持92.0%~98.0%的高CO;
DFT计算结果表明,配位不饱和Ni‐N上的*COOH自由能显著低于NiN4上的自由能,表明高ERC活性源自配位不饱和的Ni‐N位点;
高载量配位不饱和Ni‐N活性位可同时实现ERC制CO的高活性和高选择性。该研究为SACs的配位结构调控提供了一种新的调控策略。
原子水平的金属粒子表面能急剧增加,尤其是随着负载量的增加,在制备和反应时SACs容易发生团聚使催化剂失活,因此制备SACs仍具有挑战性。为应对这一挑战,Q.Wu等[54]利用一种空间位点间隔策略制备了Ni SACs。结果表明,通过调节4⁃氰基苯基卟啉镍Ni‐TPPCN和4‐氰基苯基卟啉TPPCN单体的比例,可控制相邻Ni‐N4单元的距离。因此,控制PTF‐ZnNi5中Ni原子的空间距离,可以有效地抑制热解过程中Ni的聚集;
锌原子高温热解挥发留下的N位点能进一步稳定Ni物种,从而形成完全原子分散的Ni‐N物种。Ni5‐PTF‐1000在电位为-0.60~-1.00 V时,CO选择性大于91.0%,该选择性远高于Ni20‐PTF‐1000(-1.00 V时的79.7%)和Ni100‐PTF‐1000(6.8%)的选择性。图3为Ni‐PTF‐1000单原子催化剂合成示意图。
石墨烯等二维材料具有高度有序的二维晶格结构和多种化学配位环境,在单原子锚定方面具有巨大的潜力。C.Zhang等[55]合成了分散在氮掺杂石墨烯上的Fe单原子催化剂(Fe/NG),并进行了EXAS表征及理论模拟。结果表明,Fe/NG‐750的CO在电位为-0.60 V时最大,约为80.0%;
在氮掺杂石墨烯层上存在氮约束的铁原子;
吡啶FeN4结构和氮掺杂对CO选择性的提高起至关重要的作用。通过调控单原子和催化剂之间的配位环境及金属原子与载体间的相互作用,可以调控其性能。
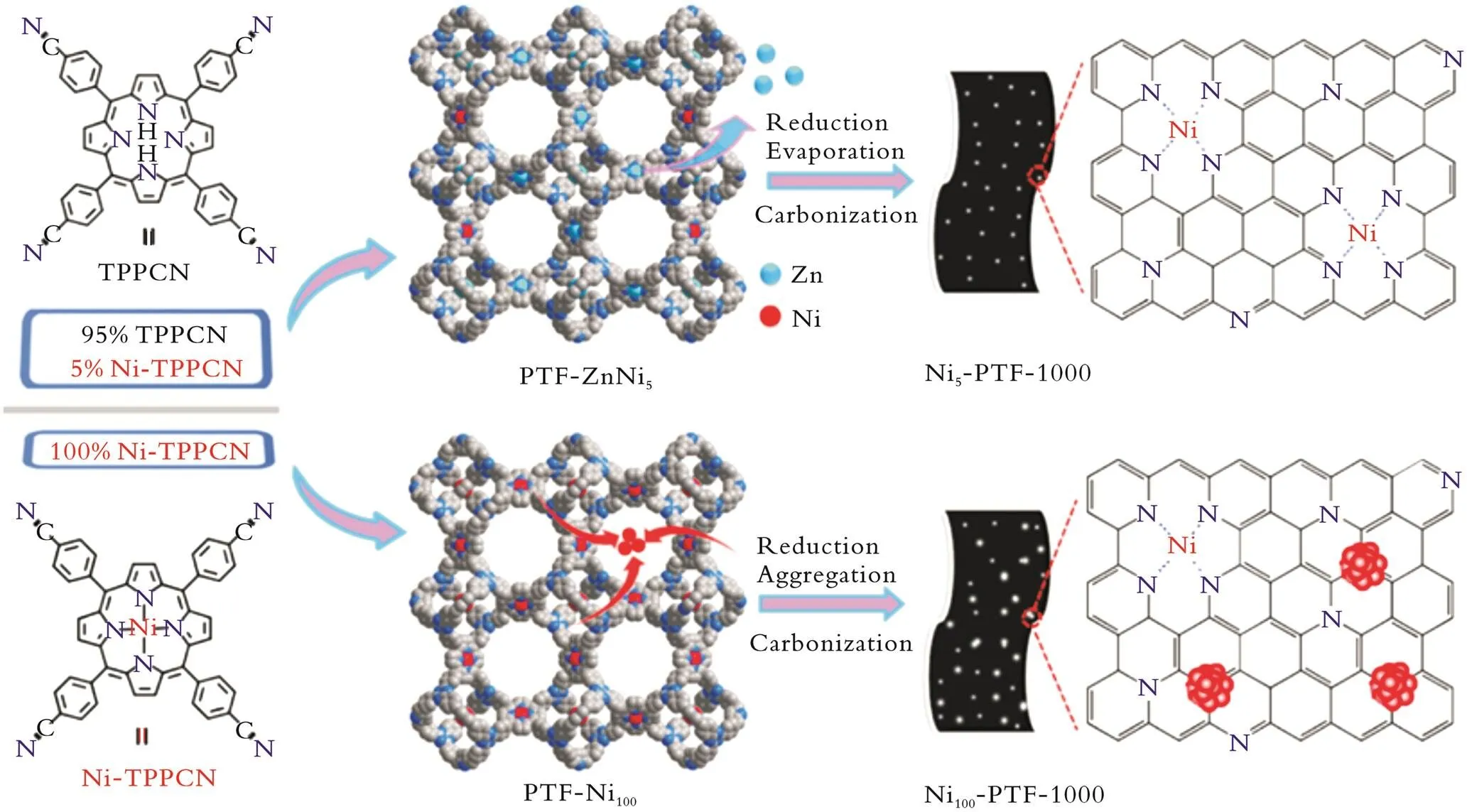
图3 Nix‐PTF‐1000单原子催化剂合成示意图
近十年来,在ERC制CO电催化剂的研究方面取得了长足进展。通过对催化剂的结构、组成进行调控,使催化剂的活性、选择性和稳定性得到大幅度提升。本文综述了近年来水溶液中ERC制CO金属催化剂的研究进展,重点介绍了单金属纳米催化剂、双金属催化剂、金属有机络合物催化剂和单原子催化剂的研究进展。对单金属纳米催化剂,调控其粒径、晶面、活性位种类,可以控制催化剂的活性和选择性;
引入第二种元素,可以调控催化剂的组成结构和形貌,优化其电子结构,调节反应中间体的活化能势垒和吸附强度;
利用核壳结构催化剂各组分间的相互作用及原子重排,可以提升催化剂的活性和选择性及稳定性;
借助金属与载体间的晶格匹配、载体匹配基团功能化、助剂及活性中心电子态调控等作用,可以实现金属有机化合物和单原子催化剂对CO2转化为CO的可控调节,实现CO定向转化。
尽管金属催化剂的ERC性能获得较好的进展,但还存在过电位高、CO低和稳定性差等问题。单原子催化剂的活性中心微环境调控仍是研究重点,单原子催化剂活性位点的均一性有待进一步研究,具有单一配位环境的单原子催化活性位点的可控性合成依然面临着挑战;
双金属催化剂的耦合机制仍需进一步阐明。因此,调控催化剂的微观结构仍是研究的主要方向。通过不同种类催化剂之间的耦合,可以提高催化剂的性能。例如,通过单原子过渡金属(Ni、Fe、Cu、Co)与含有不同氮原子种类的有机金属化合物、杂原子掺杂碳相配位的精确结构构建,单金属、双金属与金属有机化合物的耦合等方法。由于常温常压下CO2在水中的溶解度比较低,可将催化剂负载在气体扩散电极上,构建三维立体结构的电极,降低传质电阻,提高催化剂表面的反应物浓度,进而实现高电流的目标。因此,开发与催化剂相匹配的电极结构也是提高其性能的有效手段,是未来研究的重点。
目前,很多催化剂的催化机理仍不明确,例如同样是低配位数活性位,如何精准控制产物为CO,而不是其他产物。在反应过程中,催化剂的组成、结构可能会发生改变,催化剂也可能会进行重构,导致有关CO2还原的活性位点和反应机理存在争议。原位表征技术可以监测催化剂和反应中间体的动态演化,对解析反应机理至关重要。利用原位拉曼光谱和原位红外光谱可以原位监测ERC过程中反应中间体的演变;
电化学质谱和原位色谱可以监测ERC过程中催化产物的形成;
原位X‐射线衍射(XRD)和X‐射线近边吸收光谱(XAFS)结合拉曼可以监测ERC过程中催化剂的相变[61]。原位表征技术可以清楚地监测ERC反应的动态过程,结合球差电镜等表征技术与理论计算,在原子水平解析催化剂的催化机理,可为高效催化剂的设计提供理论指导。
[1]NOAA.Trends in atmospheric carbon dioxide/monthly average mauna loa CO2[EB/OL].(2022⁃11⁃15)[2022⁃01⁃05].https://gml.noaa.gov/ccgg/trends/.
[2]Nandy A,Loha C,Gu S,et al.Present status and overview of chemical looping combustion technology[J].Renewable and Sustainable Energy Reviews,2016,59:597‐619.
[3]Koytsoumpa E I,Bergins C,Kakaras E.The CO2economy:Review of CO2capture and reuse technologies[J].The Journal of Supercritical Fluids,2018,132:3‐16.
[4]周宏春.碳达峰碳中和需要创新驱动和技术支撑[J].科技与金融,2021(9):51⁃52.
Zhou H C.Carbon peaking and carbon neutrality require innovation⁃driven and technological support[J].Sci⁃Tech Finance Monthly,2021(9):51⁃52.
[5]Chen W,Filot A W,Pestman R,et al.Mechanism of cobalt⁃catalyzed CO hydrogenation:2.Fischer⁃tropsch synthesis[J].ACS Catalysis,2017,7(12):8061⁃8071.
[6]王彦,王晓月,曹瑞文,等.二氧化碳加氢制甲醇反应机理研究进展[J].辽宁石油化工大学学报,2020,40(4):11⁃20.
Wang Y,Wang X Y,Cao R W,et al.Research progress of reaction mechanism of carbon dioxide hydrogenation to methanol[J].Journal of Liaoning Shihua University,2020,40(4):11⁃20.
[7]Melaet G,Ralston W T,Li C S,et al.Evidence of highly active cobalt oxide catalyst for the fischer–tropsch synthesis and CO2hydrogenation[J].Journal of the American Chemical Society,2014,136(6):2260⁃2263.
[8]Zhao G,Huang X,Wang X,et al.Progress in catalyst exploration for heterogeneous CO2reduction and utilization:A critical review[J].Journal of Materials Chemistry A,2017,5(41):21625⁃21649.
[9]殷中枢,郭建伟,王博,等.二氧化碳电化学还原催化剂[J].科学技术与工程,2013,13(35):10560⁃10570.
Yin Z S,Guo J W,Wang B,et al.Catalysts for electrochemical reduction of carbon dioxide[J].Science Technology and Engineering,2013,13(35):10560⁃10570.
[10] Zhang S,Fan Q,Xia R,et al.CO2reduction:From homogeneous to heterogeneous electrocatalysis[J].Accounts of Chemical Research,2020,53(1):255⁃264.
[11] 周睿,韩娜,李彦光,等.铋基二氧化碳还原电催化材料研究进展[J].电化学,2019,25(4):445⁃454.
Zhou R,Han N,Li Y G,et al.Recent advances in bismuth⁃based CO2reduction electrocatalysts[J].Journal of Electrochemistry,2019,25(4):445⁃454.
[12] Schneider J,Jia H,Muckerman J T,et al.Thermodynamics and kinetics of CO2,CO,and H+binding to the metal center of CO2reduction catalysts[J].Chemical Society Reviews,2012,41(6):2036⁃2651.
[13] Dang T N,Younghye K,Yun J H,et al.Progress in development of electrocatalyst for CO2conversion to selective CO production[J].Carbon Energy,2020,2(1):72⁃98.
[14] Sun Z Y,Ma T,Tao H C,et al.Fundamentals and challenges of electrochemical CO2reduction using two⁃dimensional materials[J].Chemistry,2017,3(4):560⁃587.
[15] 郑元波,张前,石坚,等.电催化还原 CO2生成多种产物催化剂研究进展[J].化工进展,2022,41(3):1209⁃1223.
Zheng Y B,Zhang Q,Shi J,et al.Research progress of catalysts for electrocatalytic reduction of CO2to various products[J].Chemical Industry and Engineering Progress,2022,41(3):1209⁃1223.
[16] 张钰宁,钮东方,胡硕真,等.基于纳米金属的增强效应在CO2电还原反应中的应用进展[J].电化学,2020,26(4):495⁃509.
Zhang Y N,Niu D F,Hu S Z,et al.Research progress on enhancing effect of nanosized metals for electrochemical CO2reduction[J].Journal of Electrochemistry,2020,26(4):495⁃509.
[17] Mahyoub S A,Qaraah F A,Chen C,et al.An overview on the recent developments of Ag⁃based electrodes in the electrochemical reduction of CO2to CO[J].Sustainable Energy & Fuels,2020,4(1):50⁃67.
[18] Gao D,Zhou H,Wang J,et al.Size⁃dependent electrocatalytic reduction of CO2over Pd nanoparticles[J].Journal of the American Chemical Society,2015,137(13):4288⁃4291.
[19] Mistry H,Reske R,Zeng Z,et al.Exceptional size⁃dependent activity enhancement in the electroreduction of CO2over Au nanoparticles[J].Journal of the American Chemical Society,2014,136(47):16473⁃16476.
[20] Yang D R,Liu L,Zhang Q,et al.Importance of Au nanostructures in CO2electrochemical reduction reaction[J].Science Bulletin,2020,65(10):796⁃802.
[21] Liu S,Sun C,Xiao J,et al.Unraveling structure sensitivity in CO2electroreduction to near unity CO on silver nanocubes[J].ACS Catalysis,2020,10(5):3158⁃3163.
[22] Dong H,Zhang L,Yang P,et al.Facet design promotes electroreduction of carbon dioxide to carbon monoxide on palladium nanocrystals[J].Chemical Engineering Science,2019,194:29⁃35.
[23] Liu S,Wang X, Tao H,et al.Thin 5⁃fold twinned sub⁃25 nm silver nanowires enable highly selective electroreduction of CO2to CO[J].Nano Energy,2018,45:456⁃462.
[24] Fan T,Wu Q,Yang Z,et al.Electrochemically driven formation of sponge⁃like porous silver nanocubes toward efficient CO2electroreduction to CO[J].ChemSusChem,2020,13(10):2677⁃2683.
[25] Lu Y,Han B,Tian C,et al.Efficient electrocatalytic reduction of CO2to CO on an electrodeposited Zn porous network[J].Electrochemistry Communications,2018,97:87⁃90.
[26] Li Y H,Liu P F,Li C Z,et al.Sharp⁃tipped zinc nanowires as an efficient electrocatalyst for carbon dioxide reduction[J].Chemistry,2018,24(58):15486⁃15490.
[27] Torelli D A,Francis S A,Crompton J C,et al.Nickel⁃gallium⁃catalyzed electrochemical eduction of CO2to highly reduced products at low overpotentials[J].ACS Catalysis,2016,6(3):2100⁃2104.
[28] Han N,Sun M,Zhou Y,et al.Alloyed palladium⁃silver nanowires enabling stable carbon dioxide reduction to formate[J].Advanced Materials,2021,33(4):2005821.
[29] Gilroy K D,Ruditskiy A,Peng H C,et al.Bimetallic nanocrystals:Syntheses,properties,and applications[J].Chemical Reviews,2016,116(18):10414⁃10472.
[30] Wang C,Cao M,Jiang X,et al.A catalyst based on copper⁃cadmium bimetal for electrochemical reduction of CO2to CO with high faradaic efficiency[J].Electrochimica Acta,2018,271:544⁃550.
[31] Luo W,Xie W,Mutschler R,et al.Selective and stable electroreduction of CO2to CO at the copper/indium interface[J].ACS Catalysis,2018,8(7):6571⁃6581.
[32] Zhu S,Wang Q,Qin X,et al.Tuning structural and compositional effects in Pd⁃Au nanowires for highly selective and active CO2electrochemical reduction reaction[J].Advanced Energy Materials,2018,8(32):1802238.
[33] Sun K,Cheng T,Wu L,et al.Ultrahigh mass activity for carbon dioxide reduction enabled by gold⁃iron core⁃shell nanoparticles[J].Journal of the American Chemical Society,2017,139(44):15608⁃15611.
[34] Yoo C J,Dong W J,Park J Y,et al.Compositional and geometrical effects of bimetallic Cu⁃Sn catalysts on selective electrochemical CO2Reduction to CO[J].ACS Applied Energy Materials,2020,3(5):4466⁃4473.
[35] Wang M,Ren X,Yuan G,et al.Selective electroreduction of CO2to CO over co⁃electrodeposited dendritic core⁃shell indium ⁃doped Cu@Cu2O catalyst[J].Journal of CO2Utilization,2020,37:204⁃212.
[36] Wang L,Peng H,Lamaison S,et al.Bimetallic effects on Zn⁃Cu electrocatalysts enhance activity and selectivity for the conversion of CO2to CO[J].Chem Catalysis,2021,1(3):663⁃680.
[37] Han J,Li S,Chen J,et al.Dendritic Ag/Pd alloy nanostructure arrays for electrochemical CO2reduction[J].ChemElectroChem,2020,7(12):2608⁃2613.
[38] 苏文礼,范煜.金属基材料电催化CO2还原的研究进展[J].化工进展,2021,40(3):1384⁃1394.
Su W L,Fan Y.Progress of electrocatalytic reduction of CO2on metal⁃based materials[J].Chemical Industry and Engineering Progress,2021,40(3):1384⁃1394.
[39] Kornienko N,Zhao Y,Kley C S,et al.Metal⁃organic frameworks for electrocatalytic reduction of carbon dioxide[J].Journal of the American Chemical Society,2015,137(44):14129⁃14135.
[40] Kumar B,Asadi M,Pisasale D,et al.Renewable and metal⁃free carbon nanofibre catalysts for carbon dioxide reduction[J].Nature Communications,2013,4(1):2819.
[41] Jiang Z,Wang Y,Zhang X,et al.Revealing the hidden performance of metal phthalocyanines for CO2reduction electrocatalysis by hybridization with carbon nanotubes[J].Nano Research,2019,12(9):2330⁃2334.
[42] Zhu M,Chen J,Guo R,et al.Cobalt phthalocyanine coordinated to pyridine⁃functionalized carbon nanotubes with enhanced CO2electroreduction[J].Applied Catalysis B:Environmental,2019,251:112⁃118.
[43] Choi J,Wagner P,Jalili R,et al.A porphyrin/graphene framework:A highly efficient and robust electrocatalyst for carbon dioxide reduction[J].Advanced Energy Materials,2018,8(26):1801280.
[44] Zhang X,Wang Y,Gu M,et al.Molecular engineering of dispersed nickel phthalocyanines on carbon nanotubes for selective CO2reduction[J].Nature Energy,2020,5(9):1⁃9.
[45] Wang M,Torbensen K,Salvatore D,et al.Electrochemical catalytic reduction with a highly active cobalt phthalocyanine[J].Nature Communications,2019,10(1):3602⁃3609.
[46] Zhang X,Wu Z,Zhang X,et al.Highly selective and active CO2reduction electrocatalysts based on cobalt phthalocyanine/carbon nanotube hybrid structures[J].Nature Communications,2017,8:14675.
[47] Lan Y Q,Lu M,Zhang M,et al.Stable dioxin⁃linked metallophthalocyanine covalent organic frameworks as photo⁃coupled electrocatalysts for CO2reduction[J].Angewandte Chemie International Edition,2020,60(9):4864⁃4871.
[48] Liu J.Catalysis by supported single metal atoms[J].ACS Catalysis,2016,7(1):34⁃59.
[49] Yuan C Z,Li H B,Jiang Y F,et al.Tuning the activity of N⁃doped carbon for CO2reduction via in situ encapsulation of nickel nanoparticles into nano⁃hybrid carbon substrates[J].Journal of Materials Chemistry A,2019,7(12):6894⁃6900.
[50] Li Z,He D,Yan X,et al.Size⁃dependent nickel⁃based electrocatalysts for selective CO2reduction[J].Angewandte Chemie,2020,59(42):18572⁃18577.
[51] Gu J,Hsu C S,Bai L,et al.Atomically dispersed Fe3+sites catalyze efficient CO2electroreduction to CO[J].Science,2019,364(6445):1091⁃1094.
[52] Tran N H,Nastaran R,Gwenaëlle R,et al.Electrochemical reduction of CO2catalyzed by Fe-N-C materials:A structure ⁃selectivity study[J].ACS Catalysis,2017,7(3):1520⁃1525.
[53] Yan C C,Li H,Ye Y F,et al.Coordinatively unsaturated nickel⁃nitrogen sites towards selective and high⁃rate CO2electroreduction[J].Energy & Environmental Science:EES,2018,11(5):1204⁃1210.
[54] Wu Q,Liang J,Xie Z L,et al.Spatial sites separation strategy to fabricate atomically isolated nickel catalysts for efficient CO2electroreduction[J].ACS Materials Letters,2021,3(5):454⁃461.
[55] Zhang C,Yang S,Wu J,et al.Electrochemical CO2reduction with atomic iron⁃dispersed on nitrogen⁃doped graphene[J].Advanced Energy Materials,2018,8(19):1703487.
[56] Wang X,Chen Z,Zhao X,et al.Regulation of coordination number over single Co sites:Triggering the efficient electroreduction of CO2[J].Angewandte Chemie,2018,130(7):1962⁃1966.
[57] Gong Y N,Jiao L,Qian Y,et al.Regulating the coordination environment of MOF⁃templated single⁃atom nickel electrocatalysts for boosting CO2reduction[J].Angewandte Chemie International Edition,2020,59(7):2705⁃2709.
[58] Wang A,Li J,Zhang T.Heterogeneous single⁃atom catalysis[J].Nature Reviews Chemistry,2018,2:65⁃81.
[59] Ju W,Bagger A,Hao G P,et al.Understanding activity and selectivity of metal⁃nitrogen⁃doped carbon catalysts for electrochemical reduction of CO2[J].Nature Communications,2017,8(1):944.
[60] Zhao C,Dai X,Yao T,et al.Ionic exchange of metal⁃organic frameworks to access single nickel sites for efficient electroreduction of CO2[J].Journal of the American Chemical Society,2017,139(24):8078⁃8081.
[61] Li X,Wang S,Li L,et al.Progress and perspective for In situ studies of CO2reduction[J].Journal of the American Chemical Society,2020,142(21):9567⁃9581.
Research Progress of Metal Catalysts for Electrochemical Reduction of CO2to CO
Fan Lin, Yang Lei, Che Xiaozhen, Li Duo, Pan Liwei, Zhong Hexiang
(School of Environmental and Chemical Engineering,Dalian University,Dalian Liaoning 116622,China)
Electrochemical reduction of CO2to CO using renewable energy is one of the effective ways to achieve "carbon neutrality" and renewable energy storage.This review briefly described the advantages and basic principles of the electrochemical reduction of CO2and summarized the research progress of metal electrocatalysts for the electrochemical reduction of CO2to CO in aqueous solutions in recent years.Specifically,this study mainly introduced the recent research progress of mono⁃metal nanocatalysts,bimetallic catalysts,metal⁃organic complex catalysts,and mono⁃atom catalysts,which included their influences on the electrochemical reduction of CO2and relevant reaction mechanisms.The introduction was conducted from several perspectives,such as the preparation of nanoparticles as well as the regulation of their composition and structure,alloy construction,structural design of metal centers as well as their ligands and carriers,and the development of mono⁃atom catalysts. In addition, this study summarized the advantages and disadvantages of various catalysts and predicted the development trend of metal catalysts.
Carbon dioxide;
Electrochemical reduction;
Carbon monoxide;
Electrocatalyst
TQ15
A
10.3969/j.issn.1006⁃396X.2022.06.006
1006⁃396X(2022)06⁃0048⁃11
http://journal.lnpu.edu.cn
2022⁃05⁃18
2022⁃06⁃06
国家自然科学基金项目(22078034,21576255)。
范琳(1996‐),女,硕士研究生,从事CO2电化学还原方面的研究;
E‐mail:2239195848@qq.com。
钟和香(1979‐),女,博士,教授,从事CO2电化学还原、电解水及燃料电池电催化剂方面的研究;
E‐mail:zhonghexiang@dlu.edu.cn。
(编辑 王戬丽)
猜你喜欢 选择性电位原子 耳蜗微音器电位临床操作要点中国听力语言康复科学杂志(2021年6期)2021-12-21原子究竟有多小?少儿科学周刊·儿童版(2021年22期)2021-12-11原子可以结合吗?少儿科学周刊·儿童版(2021年22期)2021-12-11带你认识原子少儿科学周刊·儿童版(2021年22期)2021-12-11电位滴定法在食品安全检测中的应用食品安全导刊(2021年20期)2021-11-28选择性听力第一财经(2019年8期)2019-08-26A practical approach to (2R,3R)-2,3- dimethoxy-1,1,4,4-tetraphenyl-1,4-diol中南民族大学学报(自然科学版)(2019年1期)2019-04-04选择性Bcl-2抑制剂ABT-199对乳腺癌细胞MDA-MB-231的放疗增敏作用安徽医科大学学报(2015年9期)2015-12-16简析线性电路电位与电压的关系数理化学习·教育理论版(2013年9期)2013-12-27基于二维自适应hp有限元的自然电位高精度计算中国石油大学学报(自然科学版)(2013年6期)2013-03-11猜你喜欢
- 2024-01-20 有关于第五次全国经济普查统计重点业务综合培训大会上讲话(完整文档)
- 2024-01-20 “严纪律、转作风、保安全、树形象”专题学习教育活动通知(完整文档)
- 2024-01-20 2024XX区住房城乡建设工作情况汇报
- 2024-01-20 2024高校思政教育交流材料:善用反腐败斗争这堂“大思政课”(精选文档)
- 2024-01-20 2024年主题教育专题党课辅导报告,(4)
- 2024-01-20 关于赴某地学习考察地方立法工作情况报告(范文推荐)
- 2024-01-20 2024年度关于增强党建带团建工作实效对策与建议(精选文档)
- 2024-01-20 教师演讲稿:春风化雨育桃李,,潜心耕耘满芬芳(全文)
- 2024-01-20 主题教育第二阶段来了
- 2024-01-20 2024年度关于到信访局实践锻炼个人总结【完整版】
- 搜索
-
- 打赌输了任人处理作文1000字7篇 05-12
- 当代大学生在全面建设社会主义现代化强 05-12
- 全面建成社会主义现代化强国的战略安排 03-10
- 个人廉洁自律方面存在的问题及整改措施 05-12
- 谈谈青年大学生在中国式现代化征程上的 05-12
- 2022年党支部第一议题会议记录(全文完 11-02
- 作为青年大学生如何肩负时代责任6篇 05-12
- 村党组织建设现状及工作亮点存在问题与 05-12
- 全面从严治党,自我革命重要论述研讨会 05-12
- 产业工人队伍建设改革(全文完整) 10-31
- 11-25国庆70周年庆典晚会 庆典晚会串词
- 11-25办公室礼仪的十大原则 浅谈办公室的电话礼仪
- 01-17用心灵轻轻地歌唱_心灵的歌唱
- 01-17也许你不是我一生的唯一|也许不是我
- 01-17爱了,请珍惜;不爱,趁早放手|爱就珍惜不爱就放手
- 01-17岁月带走的是记忆,但回忆会越来越清晰|有趣又有深意的句子
- 01-17曾经的美好只是曾经,我只想珍惜身边的人|我只想珍惜你
- 01-18从容不惊 [学会笑眼去看世界,不惊不乍,淡定从容]
- 02-03当代大学生学习态度调查报告
- 02-03常用护患英语会话
- 标签列表
