首页 > 心得体会 > 学习材料 / 正文
QuEChERS前处理结合UPLC-MS/MS法测定枸杞中19种外源性风险物质残留量*
2023-05-03 14:40:13 ℃胡紫艳,史达,张珂,金鑫,陈镭,张玲
(南京市食品药品监督检验院,南京 210000)
枸杞(Lyciumbarbarum)是国家卫生健康委员会公布的药食同源品种之一,既是人们日常保健、滋补佳品,也是传统中药材,含有丰富的多糖、萜类、黄酮和生物碱等多种活性成分和氨基酸、矿物质等营养成分[1-2],其生物活性成分在抗氧化[3]、抗肿瘤[4]、抗炎[5],以及改善肠道微环境[6]等多方面具有显著的生理活性和药用价值。枸杞等中药材在培育、生长发育过程中存在广泛使用有机磷类禁用农药和植物生长调节剂的现象[7-8],但由于使用不规范,有机磷类禁用农药和植物生长调节剂的残留量超标现象日益明显,严重影响其品质和使用安全。近年来,出口枸杞因禁用农药和植物生长调节剂残留超标遭遇退运或销毁的事件时常发生,是枸杞出口面临的主要技术性贸易壁垒[9-10]。2020年版《中华人民共和国药典》未针对性的设置枸杞种植过程中常用农药和植物调节剂残留量检查项目。
QuEChERS前处理技术是由美国农业部Anastassiades M教授提出的,基于固相萃取(solid-phase extraction,SPE)和基质固相分散(matrix solid-phase dispersion,MSPD)技术改进发展的一种前处理方式。通过选用合适的固相萃取吸附剂,随同样品分散到萃取液中,吸附干扰物,保留目标物,以实现快速(quick)、简单(easy)廉价(cheap)、高效(effective)、稳定(rugged)和安全(safe)的净化基质,以满足分析检测要求[11]。目前,QuEChERS技术已广泛应用于食品、中药材等复杂基质中农药、植物生长调节剂风险物质残留量检测的前处理过程中[12-13]。
因此,本文选用枸杞种植过程中常用的13种禁用有机磷类农药和6种植物生长调节剂为研究对象,建立一种基于QuEChERS提取净化和超高液相色谱-三重四级杆串联质谱联用(UPLC-MS/MS)的检测方法,为枸杞中农药残留分析检测提供一种快速、可靠的分析方法,并应用该方法对市售50批枸杞进行19种外源性风险物质残留量的测定,以保证枸杞质量安全。
1.1仪器 UPLC-MS/MS 6470液相色谱-三重四级杆质谱联用仪(美国安捷伦公司);
XS205DU电子分析天平(梅特勒-托利多仪器有限公司,感量:0.1 mg);
DC24H氮吹仪(上海安谱科学仪器有限公司);
ALLEGRAX-30R高速离心机(贝克曼库尔特有限公司);
Milli-Q超纯水仪(德国默克集团);
KQ-800DE超声清洗仪(昆山市超声仪器有限公司);
TM-2F涡旋振荡器(德国WIGGENS集团);
QuEChERS萃取盐包(无水硫酸镁、醋酸钠),QuEChERS净化包(无水硫酸镁、PSA和C18EC,美国安捷伦公司)。
1.2药品与试剂 乙腈(色谱纯,德国Merck公司);
甲酸(色谱纯,德国Fluka公司);
乙酸铵为色谱纯,购自上海阿拉丁生化科技股份有限公司;
试验用水为超纯水。
用于质量分析的19种外源性风险物质标准品信息见表1,以乙腈为溶剂,稀释19种标准品的浓度为10 μg·mL-1,作为混合标准储备液,置于-18 ℃冰箱储存。50批市售枸杞样品产自宁夏、青海、新疆、河北等地。

表1 标准物质的相关信息
2.1色谱条件 采用Agilent HD C18色谱柱(50 mm×2.1 mm,1.8 μm);
柱温40 ℃;
流动相A为5 mmol·L-1醋酸铵溶液(含0.1%甲酸),流动相B为乙腈,流速为0.3 mL·min-1。梯度洗脱(0~2.0 min,95% A;
2.0~5.0 min,95%→25% A;
5.0~9.0 min,25%→10% A)。
2.2质谱条件 电喷雾离子源,正负离子同时扫描;
多反应监测(MRM)模式;
毛细管电压:4000 V(+)3500 V(-);
雾化气:氮气(N2);
干燥气温度:300 ℃;
干燥气流速:6 L·min-1;
喷雾电压:500 V;
鞘气温度:350 ℃;
鞘气流速:11 L·min-1。19种外源性风险物质主要质谱参数见表2。
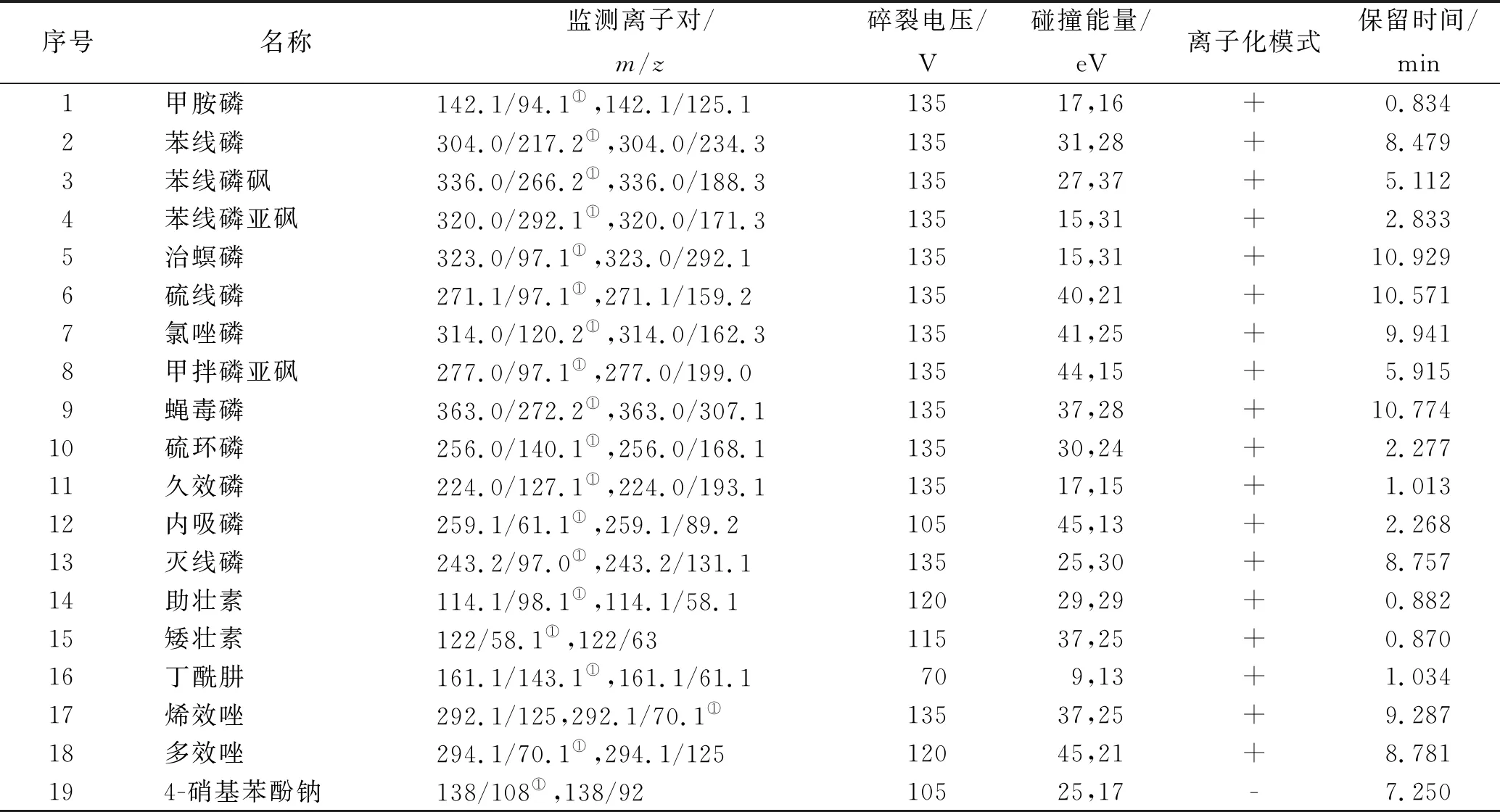
表2 19种外源性风险物质主要质谱参数
2.3标准溶液配制 混合标准溶液:分别准确移取各农药标准储备液1 mL于同一50 mL量瓶中,用乙腈定容,配制成200 ng·mL-1的混合标准溶液,置于-18 ℃冰箱保存。
标准工作溶液:准确移取适量混合标准溶液,用乙腈稀释,配制成质量浓度为5,10,50,100,200 ng·mL-1的混合标准工作溶液。
2.4样品前处理
2.4.1提取 精密称取粉碎后枸杞(5.0 g)置50 mL离心管中,精密加1%甲酸溶液15 mL和一粒陶瓷均质子,涡旋使药物充分浸润,放置30 min,再精密加入乙腈(色谱级)15 mL,涡旋5 min,加QuEChERS萃取盐包(无水硫酸镁6 g和无水醋酸钠1.5 g),立即摇散,置振荡器上剧烈振摇3 min,于冰浴中冷却10 min,8000 r·min-1(r=93 mm),离心5 min。
2.4.2净化 精密移取清液10 mL置分散固相萃取净化管(900 mg无水硫酸镁、150 mg PSA、150 mg C18EC)中,涡旋充分混匀,再置振荡器上剧烈震荡5 min,8000 r·min-1,离心5 min,精密取上清液5 mL于玻璃试管中,置氮吹仪上浓缩至0.4 mL(40 ℃),加乙腈至约0.9 mL,涡旋混匀约15 s,再用乙腈定容到1 mL,涡旋混匀15 s。
2.5方法学考察
2.5.1线性关系考察 取未检出19种外源性风险物质的枸杞样品(编号:Q190805),按“2.4”项下方法处理得到的提取溶液为溶剂,加适量混合标准溶液,分别配制5,10,50,100,200 ng·mL-1的系列基质标准工作溶液,以标准溶液质量浓度(X)为横坐标,峰面积(Y)为纵坐标,绘制标准工作曲线。实验结果表明,19种外源性风险物质浓度在5~200 ng·mL-1范围内,标准曲线相关系数(r)均大于0.995,分析结果见表3。19种外源性风险物质典型色谱图见图1。

图1 19种外源性风险物质典型定性、定量离子色谱图

续图1 19种外源性风险物质典型定性、定量离子色谱图
2.5.2回收率和重复性 取未检出19种外源性风险物质的枸杞样品(编号:Q190805),粉碎后精密称取5.0 g,作为空白基质样品,分别精密加入浓度为100 ng·mL-1的混合标准溶液125,250,1.25 mL,按“2.4”项下方法处理,得到12.5,25,125 ng·mL-1,3个水平的模拟样品考察回收率,每个浓度制备6份平行样品,19种外源性风险物质的回收率平均值在87.2%~115.1%,重复性RSD≤15%,见表3。说明该方法对枸杞中19种外源性风险物质的测定,具有良好的准确度和重复性。
2.5.3稳定性 取“2.5.1”项下混合对照溶液和“2.5.2”项下样品加标溶液,在室温下分别于0,2,4,6,8 h进样,测定19种外源性风险物质的峰面积,结果19种外源性风险物质的峰面积RSD均<12%,说明混合对照品溶液和样品加标溶液在室温8 h内稳定。
2.5.4检出限与定量限 取“2.5.1”项下浓度为5 ng·mL-1混合对照溶液,采用逐级稀释法稀释,以信噪比S/N≥3时样品中待测物的含量为检出限,S/N≥10时为定量限,19种外源性风险物质的检出限和定量限结果见表3。

表3 19种外源性风险物质线性方程、相关系数、加样回收率、精密度、检出限、定量限和基质效应
2.5.5基质效应评价 基质效应(ME)是指基质成分和目标化合物在进行离子化时,因相互竞争而导致目标化合物信号强度有不同程度增强或减弱的现象,包括基质增强效应和基质抑制效应。本文采用提取后添加法,将阴性枸杞样品按“2.4”项方法处理,得空白基质溶液。分别用空白基质溶液和纯溶剂配制标准曲线,按以下公式计算基质效应。
基质效应(%)=(空白基质标曲的斜率-溶剂标曲的斜率)/溶剂标曲的斜率×100%
基质效应在±20%以内为弱基质效应,在±50%以内为中等基质效应。研究结果发现,19种外源性风险物质存在不同程度的基质效应,基质效应均在±30%以内,为减小基质效应的影响,本文采用空白基质溶液配制标准曲线进行定量。
2.5.6样品测定 采用优化后的方法对市售不同产地的50批次枸杞样品进行19种外源性风险物质残留量的检测,以色谱峰的保留时间、定性离子与定量离子丰度比进行定性分析,定量离子对进行定量分析。其中18批检出矮壮素、助壮素、4-硝基苯酚钠植物生长调节剂残留;
11批检出克百威、治螟磷2种禁用农药,50批样品来源信息和检测结果见表4。

表4 50批样品来源信息和检测结果
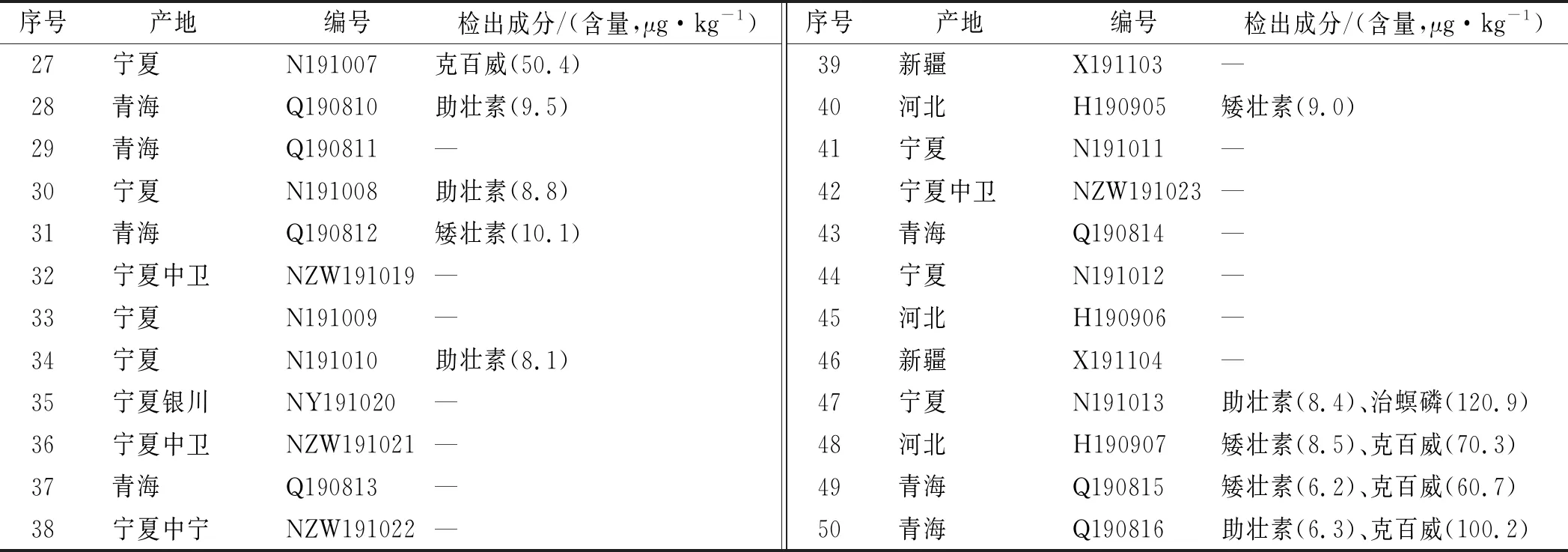
续表4 50批样品来源信息和检测结果
3.1UPLC-MS/MS条件的优化 采用不接分析柱的方式向质谱系统注入1 μg·mL-1标准溶液1 μL,确定各化合物的响应最高的2个特征离子对、碎裂电压和碰撞能量等质谱最佳条件。在流动相的选择中,分别比较了甲醇与乙腈两种有机相,实验结果发现,乙腈为有机相的分离效果略优于甲醇,故采用乙腈为有机相。考察了水、0.1%甲酸溶液和5 mmol·L-1醋酸铵溶液(含0.1%甲酸)3种水相,实验结果发现,5 mmol·L-1醋酸铵溶液(含0.1%甲酸)能够显著提高化合物的响应,且在一定程度上能缓解色谱峰拖尾。
3.2提取、净化条件选择 枸杞基质较为复杂,含有多糖、有机酸、蛋白质、脂肪、色素[14]等多种物质干扰测定,乙腈因具有较好的共萃性和分层性,是农药残留检测中常用的提取溶剂,本文研究参照《中华人民共和国药典》四部通则2341农药残留量测定法、《食品安全国家标准》中水果蔬的农残提取方法以及文献[15-17]方法,优化提取、净化条件,枸杞中水的存在会导致部分疏水性较强的植物生长调节剂回收率极低,因此加入萃取盐包除去样品中水分,提高萃取效率;
净化管中PSA可净化枸杞中有机酸、糖类和部分色素,C18EC可以有效净化酯类。
在中药高质量发展的推动下,科学有效地评价中药质量是当前质量控制中研究的重点和难点,目前对中药质量标准研究仍然停留在对有效成分的研究,缺少安全性的评价[18-19]。枸杞作为我国中药材走向世界的代表之一,如何利用现代分析技术和检测设备多元化的分析及评价枸杞质量是我们要解决的问题。
枸杞在种植过程中广泛使用农药和植物调节剂带来的残留问题已引起国内外普遍关注。有机磷类禁用农药具有类雌激素和“三致”(致癌、致畸、致诱变)作用,并易堆积于肝、肾、脾等组织中,导致急性或慢性中毒。植物生长调节剂,会影响中药材的有效性和安全性,主要体现为显著影响中药材化学成分的积累量和组成比,其在药材中的残留会危害服用者身体健康,盲目使用带来的高残留会引起肝毒性、生殖毒性、免疫毒性等[20]。
本论文通过应用QuEChERS净化,以液相色谱-质谱/质谱法建立了同时检测枸杞中19种有机磷农药和植物生长调节剂等外源性风险物质残留量的方法。实验分别对前处理方法、色谱质谱条件进行了优化,采用多反应监测模式检测,测定了枸杞种植过程中可能使用的有机磷类禁用农药和植物生长调节剂类。该方法具有灵敏度高、普适性强、操作简便等优点,适用于枸杞农药残留量的测定,可为保障枸杞食用、药用安全提供有效的技术支撑。
猜你喜欢外源性调节剂枸杞是酸是碱?黑枸杞知道学与玩(2022年2期)2022-05-03止血镇痛胶囊对外源性雌激素干预下未成年雌性大鼠卵巢和子宫的影响世界科学技术-中医药现代化(2020年2期)2020-07-25宁夏六月枸杞红绿色中国(2019年13期)2019-11-26外源性防御肽(佰润)对胸腔镜术后气道黏膜修复的影响国际呼吸杂志(2019年8期)2019-04-29枸杞到底是怎么养生的?基层中医药(2018年10期)2018-12-06植物生长调节剂在园艺作物上的应用现代园艺(2018年3期)2018-02-10麦冬中外源性有害物质的分析中成药(2017年9期)2017-12-19哮喘治疗中白三烯调节剂的应用观察中国继续医学教育(2015年5期)2016-01-07外源性红花黄色素掺伪葡萄酒鉴别检测方法的研究中国酿造(2014年9期)2014-03-11抗肿瘤药及免疫调节剂的医院用药现状中国合理用药探索(2011年3期)2011-03-20猜你喜欢
- 2024-01-20 有关于第五次全国经济普查统计重点业务综合培训大会上讲话(完整文档)
- 2024-01-20 “严纪律、转作风、保安全、树形象”专题学习教育活动通知(完整文档)
- 2024-01-20 2024XX区住房城乡建设工作情况汇报
- 2024-01-20 2024高校思政教育交流材料:善用反腐败斗争这堂“大思政课”(精选文档)
- 2024-01-20 2024年主题教育专题党课辅导报告,(4)
- 2024-01-20 关于赴某地学习考察地方立法工作情况报告(范文推荐)
- 2024-01-20 2024年度关于增强党建带团建工作实效对策与建议(精选文档)
- 2024-01-20 教师演讲稿:春风化雨育桃李,,潜心耕耘满芬芳(全文)
- 2024-01-20 主题教育第二阶段来了
- 2024-01-20 2024年度关于到信访局实践锻炼个人总结【完整版】
- 搜索
-
- 打赌输了任人处理作文1000字7篇 05-12
- 当代大学生在全面建设社会主义现代化强 05-12
- 全面建成社会主义现代化强国的战略安排 03-10
- 个人廉洁自律方面存在的问题及整改措施 05-12
- 谈谈青年大学生在中国式现代化征程上的 05-12
- 2022年党支部第一议题会议记录(全文完 11-02
- 作为青年大学生如何肩负时代责任6篇 05-12
- 村党组织建设现状及工作亮点存在问题与 05-12
- 全面从严治党,自我革命重要论述研讨会 05-12
- 产业工人队伍建设改革(全文完整) 10-31
- 11-25国庆70周年庆典晚会 庆典晚会串词
- 11-25办公室礼仪的十大原则 浅谈办公室的电话礼仪
- 01-17用心灵轻轻地歌唱_心灵的歌唱
- 01-17也许你不是我一生的唯一|也许不是我
- 01-17爱了,请珍惜;不爱,趁早放手|爱就珍惜不爱就放手
- 01-17岁月带走的是记忆,但回忆会越来越清晰|有趣又有深意的句子
- 01-17曾经的美好只是曾经,我只想珍惜身边的人|我只想珍惜你
- 01-18从容不惊 [学会笑眼去看世界,不惊不乍,淡定从容]
- 02-03当代大学生学习态度调查报告
- 02-03常用护患英语会话
- 标签列表
