首页 > 心得体会 > 学习材料 / 正文
miR-888,和miR-891a,的双重微滴式数字PCR,检测在精液鉴定中的应用
2023-05-05 11:05:04 ℃魏孙祥,陈惠香,胡胜,赵一霞,石慧霞,王哲,李文,季安全,孙启凡
1.山西医科大学法医学院,山西 太原 030001;
2.公安部鉴定中心 现场物证溯源技术国家工程实验室法医遗传学公安部重点实验室,北京 100038
确定案发现场遗留的体液斑迹组织属性对于推断案件性质、重建犯罪现场等具有重要意义[1-2],其中精液(斑)是法医物证鉴定中常见的生物物证,尤其对于强奸、猥亵案件至关重要。
微小RNA(microRNA,miRNA)是一种长度为18~24 个碱基的非编码RNA,具有高稳定性、强保守性、良好的组织特异性、可兼容DNA 同步分析等优势,是法医学体液鉴定的重要工具[3-8]。微滴式数字聚合酶链反应(droplet digital polymerase chain reaction,ddPCR)是一种高灵敏度、高精确性的定量方法,对于低浓度核酸分子检测结果的可重复性好,可用于miRNA 的绝对定量检测[9-10]。研究[5-6]结果表明,miR-888 和miR-891a 具有良好的精液特异性,可通过对其表达量的检测进行精液鉴定,但目前使用的检测方法均为实时荧光定量反转录聚合酶链反应(real time fluorescent quantitative reverse transcription polymerase chain reaction,RT-qPCR)相对定量法,使用不同的内参基因可能会对检测结果作出不同的解释[11],受抑制剂、检测平台和扩增效率影响较大,对结果的解释不够直接和客观[12]。
本研究旨在建立可同时检测miR-888和miR-891a的双重ddPCR 检测体系,通过绝对定量对miR-888 和miR-891a 作为精液特异性标记的可靠性进行评估,以期为精液鉴定提供更科学、准确的方案。
1.1 材料
1.1.1 主要仪器和试剂
QX200 AutoDG 微滴式数字PCR 系统(美国Bio-Rad 公司),包括自动化微滴生成器、PX1 PCR 反应板热封仪、带96-深孔反应模块的C1000 Touch 热循环仪和QX200TM微滴读取器;
NanoDrop 2000c 分光光度计(美国Thermo Fisher Scientific 公司)。
miRNeasy Mini试剂盒(德国Qiagen公司),TaqManTMMicroRNA逆转录试剂盒(美国Thermo Fisher Scientific公司),ddPCR超混合液(无dUTP,美国Bio-Rad公司)。
1.1.2 引物、探针设计与标准品RNA 合成
miR-888、miR-891a 的成熟序列[5]及引物和探针信息见表1,探针的报告基团分别采用6-FAM 和HEX荧光修饰。自行设计引物、探针后由生工生物工程(上海)股份有限公司合成。miR-888、miR-891a 标准品RNA 由宝生物工程(大连)有限公司合成。

表1 miR-888、miR-891a 的成熟序列及引物和探针信息Tab.1 Information of mature sequences,primers and probes of miR-888 and miR-891a
1.1.3 样本制备
对75 名来自中国北方地区年龄在25~35 岁的健康志愿者进行样本采集,收集5 种法医学相关体液样本共75 份,其中精液35 份,外周血、月经血、唾液、阴道分泌液各10 份。
外周血通过静脉穿刺收集后置于乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)抗凝采血管内。
唾液使用无菌塑料管收集(样本收集前志愿者禁食1 h)。
精液使用无菌广口塑料杯收集(样本收集前,志愿者禁欲2 d)。
月经血(于月经周期的第2 天或第3 天采集)和阴道分泌液使用卫生棉条获取。
所有样本采集制备后均储存于-80 ℃备用。
本研究已通过公安部鉴定中心伦理委员会的审查(审批文号:2020-024),所有志愿者均已签署知情同意书。
1.2 方法
1.2.1 RNA 提取和定量
按照miRNeasy Mini 试剂盒操作说明书进行总RNA 的提取[13],使用NanoDrop 2000c 分光光度计测定总RNA 的质量浓度和纯度(D260/D280)[8]。
1.2.2 互补DNA(complementary DNA,cDNA)合成
采用茎环反转录法[8],按照TaqManTMMicroRNA逆转录试剂盒操作说明书进行反转录。每15 μL 反应体系包括总RNA 10 ng,脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTP)预混液(100 mmol/L)0.15 μL,MultiScribeTM逆转录酶(50 U/μL)1.00 μL,10×反转录缓冲液1.50 μL,RNA 酶抑制剂(20 U/μL)0.19 μL,miR-888逆转录茎环引物(1 μmol/L)0.15 μL,miR-891a 逆转录茎环引物(1 μmol/L)0.15 μL,加无核酸酶水(日本TaKaRa 公司)至15 μL。设置反转录阴性对照(用无核酸酶水取代逆转录酶)。反应条件:16 ℃ 30 min,42 ℃ 30 min,85 ℃ 5 min,4 ℃保持。
1.2.3 双重ddPCR 检测体系的建立和优化
按照微滴生成、PCR 扩增和微滴读取3个步骤进行体系的建立。首先针对miR-888 和miR-891a 建立单独的ddPCR 检测体系,在此基础上,通过优化退火温度和热循环数,建立双重ddPCR 检测体系。
(1)微滴生成。双重ddPCR 检测miR-888和miR-891a,每22 μL 反应体系包括探针用ddPCR 超混合液(无dUTP)11 μL,cDNA 1.1 μL,通用反向引物(20 μmol/L)0.99 μL,miR-888、miR-891a 特异性正向引物(20 μmol/L)各0.99 μL,miR-888、miR-891a 荧光探针(20 μmol/L)各0.275 μL,无核酸酶水6.38 μL。设置阴性对照(使用无核酸酶水代替cDNA 作为模板)。将样品转移至96 孔板中,于自动化微滴生成器中生成微滴,放置另一96 孔板以接收生成的微滴。
(2)PCR 扩增。将接收微滴的96 孔板盖膜,封膜,PCR 扩增。PCR 扩增程序:95 ℃ 10 min;
94 ℃ 30 s,56~62 ℃ 60 s,72 ℃ 30 s,45 个循环;
98 ℃ 10 min,4 ℃保持。升降温速度为2 ℃/s。miR-888、miR-891a的单独检测及双重检测均使用此反应条件。
(3)微滴读取。扩增完毕后,在QX200TM微滴读取器上读取微滴数据,采用QuantaSoft v1.7.4软件(美国Bio-Rad公司)获取目标片段的拷贝浓度。包含10 000个以上微滴的反应被视为有效反应,并用于数据分析[14-15]。
(4)双重ddPCR 检测条件优化。优化ddPCR 反应条件,包括退火温度和热循环数。使用带96-深孔反应模块的C1000 Touch 热循环仪温度梯度功能进行PCR 扩增退火温度的优化,设置退火温度梯度为:62 ℃、61.6 ℃、60.9 ℃、59.8 ℃、58.4 ℃、57.3 ℃、56.5 ℃、56 ℃。设置热循环数为35、40、42、43、45、46 个。
1.2.4 双重检测与单独检测的结果比较
为验证双重ddPCR 检测体系的准确性,使用双重体系与单一体系同时对随机挑选的4 份精液样本进行miR-888 和miR-891a 的检测和拷贝浓度比较。双重ddPCR 检测体系为在同一反应孔内加入miR-888 和miR-891a 的正反向引物和探针,其中miR-888和miR-891a 的引物浓度配比为1∶1,利用5′端不同荧光修饰的探针可同时检测这两种miRNA。单独miRNA 检测体系为在同一反应孔内仅加入其中一个miRNA 的引物和探针,用无核酸酶水代替另一个miRNA 的引物和探针,即miR-888 和miR-891a 在不同反应孔内单独进行检测。
1.2.5 灵敏度检测
对随机挑选的6 份样本(精液2 份、外周血1 份、月经血1份、唾液1份、阴道分泌液1份)提取的总RNA从10 ng 开始进行10 倍梯度稀释,共4 个梯度,即总RNA 量分别为10 ng、1 ng、0.1 ng、10 pg,利用1.2.3 节建立和优化后的双重ddPCR 检测体系进行检测。
1.2.6 重复性检测
对miR-888、miR-891a标准品RNA 各5 ng进行稀释,稀释倍数分别为2 500、12 500、62 500、312 500 倍。以不同浓度的标准品核酸为模板,使用1.2.3 节建立和优化后的双重ddPCR 检测miR-888 和miR-891a,每个浓度设立3个复孔,计算其变异系数,以评价检测方法在不同浓度下的批内重复性。在同样的反应条件下进行2 次试验(每次试验每个浓度设置3 个重复求平均值作为结果),计算其变异系数,评价该方法的批间重复性。
1.2.7 数据分析
采用配对样本t检验对ddPCR 双重检测与单独检测的结果进行差异性分析,采用Mann-WhitneyU检验对精液与其他常见体液中目标片段的拷贝浓度进行差异性分析,通过受试者操作特征(receiver operator characteristic,ROC)曲线分析,根据曲线下面积(area under the curve,AUC)评估miR-888 和miR-891a区分精液的能力,并计算约登指数(Youden index)确定最佳的鉴别截断值。使用GraphPad Prism 9.0 软件(美国GraphPad Software 公司)进行统计分析,检验水准α=0.05。
2.1 总RNA 的质量浓度和纯度
本研究5 种体液共75 份样本提取后的总RNA 质量浓度和纯度见表2。不同类型体液之间的总RNA质量浓度和纯度具有一定差别。外周血样本具有最高的质量浓度,而唾液样本的质量浓度始终较低。所提总RNA 的平均纯度在(1.75±0.10)~(1.99±0.06)。
表2 5 种体液的总RNA 质量浓度和纯度Tab.2 Mass concentration and purity of total RNA extracted from 5 body fluids(±s)
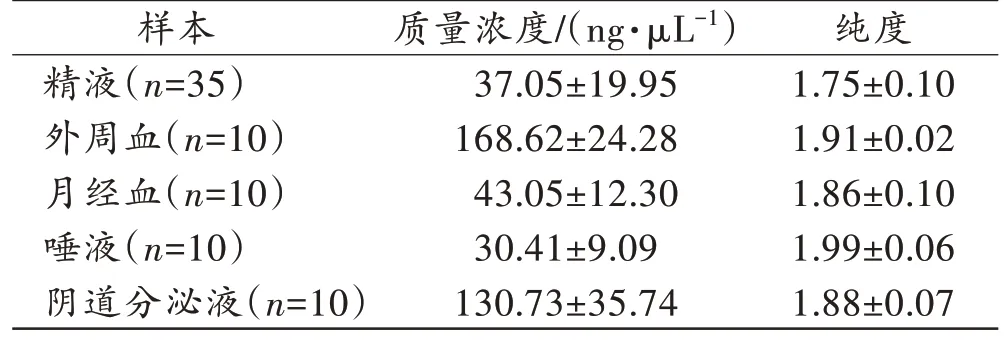
表2 5 种体液的总RNA 质量浓度和纯度Tab.2 Mass concentration and purity of total RNA extracted from 5 body fluids(±s)
2.2 双重ddPCR 检测体系的建立和优化
如1.2.3节所述,经退火温度梯度实验(56~62 ℃),根据两个检测通道阳性微滴和阴性微滴的分离状态,将退火温度设为56.5 ℃;
分别尝试将热循环数设为35、40、42、43、45、46 个,发现当扩增效率较低时,适当增加热循环数能够提高阳性微滴信号,并使其更加集中分布,有利于阳性和阴性信号的区分,最终将最优热循环数设置为45 个。
经优化后,双重ddPCR检测miR-888和miR-891a的扩增图见图1。

图1 双重ddPCR 检测miR-888 和miR-891a 的扩增图Fig.1 Amplification plots of miR-888 and miR-891a detected by duplex ddPCR
2.3 双重检测与单独检测的结果比较
4 份精液样本经ddPCR 双重检测与单独检测的结果见表3,经配对样本t检验,两种方法得出的目标片段拷贝浓度差异无统计学意义(P>0.05)。
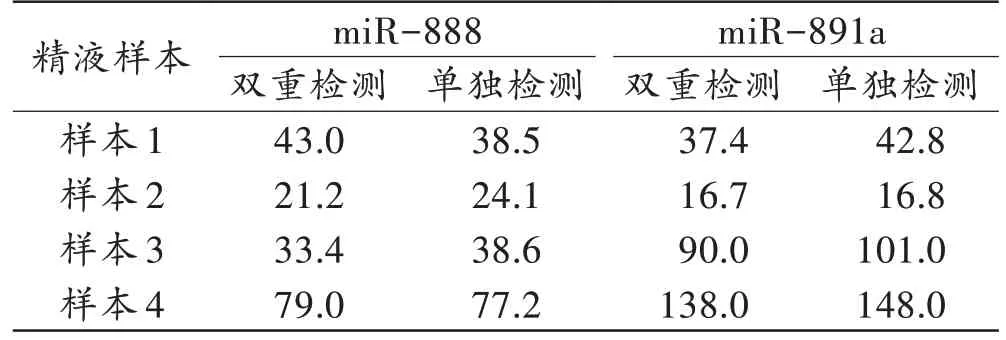
表3 精液样本经ddPCR 双重检测和单独检测的目标片段拷贝浓度Tab.3 The target fragment copy concentrations of semen samples detected by duplex ddPCR and single ddPCR(copies/μL)
2.4 灵敏度检测
双重ddPCR 检测体系的灵敏度检测结果见图2。当稀释100 倍后(0.1 ng 总RNA),该体系仍然能准确地从5种体液中鉴别出精液。当总RNA 量为10 pg时,该体系在月经血中检测出1 个miR-888 阳性微滴、在阴道分泌液中检测出1 个miR-891a 阳性微滴从而出现假阳性。因此,使用该体系时,初始总RNA 的质量至少需要0.1 ng。
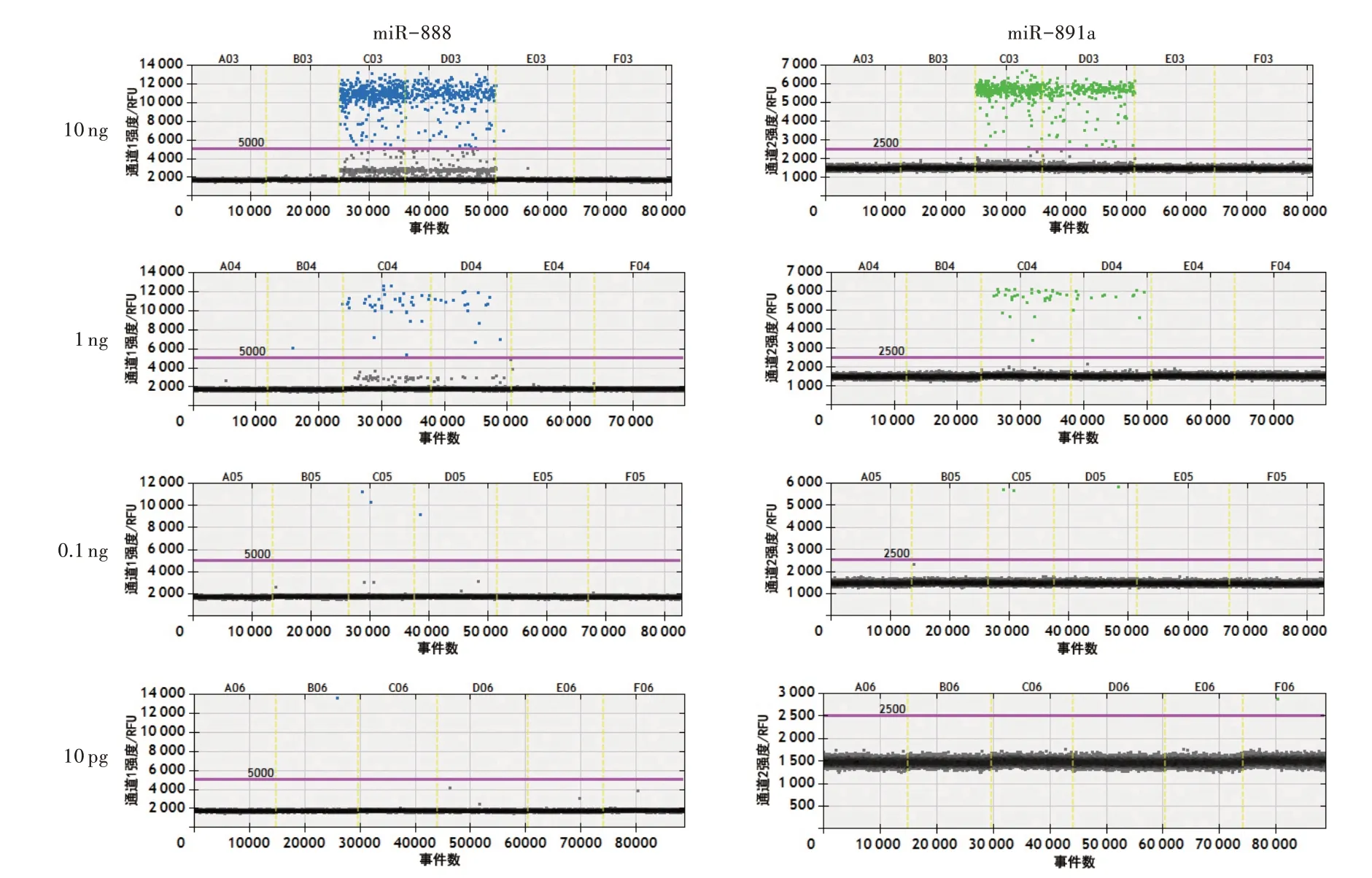
图2 双重ddPCR 检测体系的灵敏度检测结果Fig.2 Sensitivity test results of duplex ddPCR detection system
2.5 重复性检测
以4 种稀释倍数的标准品核酸为模板,使用双重ddPCR 检测miR-888 和miR-891a,计算得到miR-888的批内变异系数分别为1.86%、2.12%、5.60%和10.72%,miR-891a的批内变异系数分别为1.56%、0.71%、1.17%和2.03%(表4);
miR-888的批间变异系数分别为2.27%、1.03%、2.39%和3.91%,miR-891a 的批间变异系数分别为1.78%、0.78%、6.90%和6.98%。4 种稀释倍数下的批内和批间变异系数均小于15%。
表4 4 种稀释倍数下标准品的拷贝浓度Tab.4 Copy concentrations of standard substances at 4 dilutions(n=3,±s,copies·μL-1)

表4 4 种稀释倍数下标准品的拷贝浓度Tab.4 Copy concentrations of standard substances at 4 dilutions(n=3,±s,copies·μL-1)
2.6 精液与其他常见体液表达的差异性分析
本研究对5种体液共75份样本进行了双重ddPCR检测,结果见表5。将精液分别与外周血、月经血、唾液、阴道分泌液中miR-888 和miR-891a 的检测结果进行Mann-WhitneyU检验,miR-888 和miR-891a 在精液中的表达量高于其他体液(P<0.05)。
表5 5 种体液中miR-888 和miR-891a 的拷贝浓度Tab.5 Copy concentrations of miR-888 and miR-891a in 5 body fluids(±s,copies·μL-1)

表5 5 种体液中miR-888 和miR-891a 的拷贝浓度Tab.5 Copy concentrations of miR-888 and miR-891a in 5 body fluids(±s,copies·μL-1)
注:1)与精液样本比较,P<0.05。
2.7 ROC 曲线分析
对精液与非精液样本中miR-888 和miR-891a 的拷贝浓度进行ROC 曲线分析,结果见图3。miR-888的AUC 为0.976,最佳截断值为2.250 copies/μL,此时灵敏度为94.29%,特异性为100%,约登指数为0.943,75 份样本中有2 份精液样本被误判为非精液,判别正确率为97.33%;
miR-891a 的AUC 为1.000,最佳截断值为1.100 copies/μL,此时灵敏度和特异性均为100%,约登指数为1,75 份样本均被正确判别。
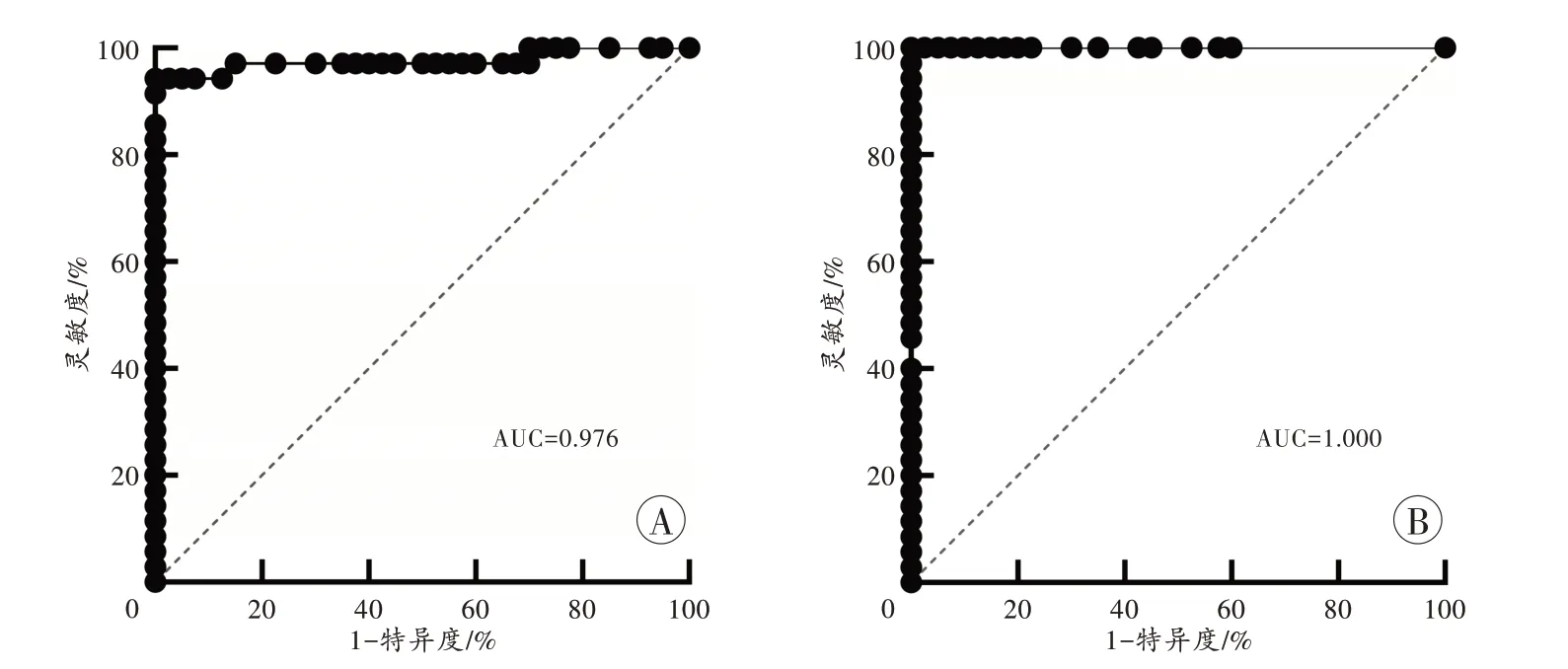
图3 ROC 曲线分析结果Fig.3 Analysis results of ROC curve
一直以来,RT-qPCR 被认为是检测miRNA 表达量的金标准[16-17],也是目前基于miRNA 进行体液鉴定的主要检测方法,但该方法一方面需要科学准确地选择内参基因进行相对定量分析[11],或通过已知浓度的标准品制作标准曲线以进行绝对定量;
同时,qPCR 针对不同的目标基因需要设计单独的检测体系,复合检测难度较大,无形中限制了其在法医学实践中的广泛应用。ddPCR 是近些年逐渐发展成熟的一种可对微量核酸进行绝对定量检测的方法,其原理是将待测样品分成数万个微滴,每个微滴不含或含有至少1 个待检核酸靶分子,经过独立PCR 反应后,对微滴进行逐个检测,最终根据泊松分布原理及阳性微滴比例给出待检靶分子的拷贝浓度[9-10]。
本研究将ddPCR 技术引入法医学体液鉴定领域,克服了miRNA 序列较短,引物和探针的设计较为复杂等技术难点,自行设计TaqMan 探针,分别选择6-FAM 和HEX 荧光修饰的报告基团用于两条miRNA探针,建立双重ddPCR 检测体系,实现了miRNA 的ddPCR 双通道检测,可同时对miR-888 和miR-891a两种miRNA 进行绝对定量分析,经配对样本t检验,ddPCR 双重检测与单独检测结果差异无统计学意义,说明双重ddPCR 检测结果可信,能够达到与单独ddPCR 检测同样的准确性。经重复性试验,批内和批间变异系数均小于15%,说明该体系稳定性和重复性良好[18],检测结果准确、可靠。探针根据以下原则进行设计:跨越茎环序列和miRNA 成熟序列连接处且不与正向引物重叠,尽可能增加长度以提高解链温度(melting temperature,Tm)值,同时设计5′报告基团、3′淬灭基团以及3′小沟结合物(minor groove binder,MGB)[19]。与传统的TaqMan 探针相比,MGB 探针能够在显著提高Tm的同时增加特异性,尤其是当错配发生在MGB区域时,单个碱基不匹配就能显著降低DNA双链的Tm值[20]。这些性质决定了MGB 探针尤其适用于长度较短的核酸(如miRNA)和单碱基突变等研究。
miR-888 最初被定义为附睾特异性表达的miRNA[21],是一种前列腺分泌液来源的miRNA,具有促进前列腺细胞增殖、迁移和集落形成的功能[22],miR-891a 的功能和作用研究相对较少,但miR-891a与miR-888 同样位于人类X 染色体上同一miRNA 集群中,分布稳定且集中,具有较强的精液特异性[5-6,23-24]。本研究结果支持以上结论。通过检测5种体液共75份样本中miR-888 和miR-891a 的拷贝浓度,经非参数检验证实了miR-888 和miR-891a 在精液中的表达量均高于其他常见体液。经ROC分析,miR-888和miR-891a 均具有很高的鉴别精液的能力,且两者相比,miR-891a 的判别正确率高于miR-888。在本研究使用的75 份样本中,仅通过miR-891a 的表达情况即可区分精液与其他体液,且当截断值定为1.100 copies/μL时,判别正确率可达100%。将miR-888 和miR-891a结合使用,能够进一步增加结果的可信度,避免检测单个标记造成的假阳性或假阴性。此外,大多数法医学生物检材为微量降解样本,因此,灵敏度是评估检测体系法医学实际应用能力的重要指标。经灵敏度检测,该体系在仅使用0.1 ng 总RNA 时仍然能准确区分出精液,具有较好的应用前景。有研究[25]表明,ddPCR 在检测空白样品时可能会由于检出1 个阳性微滴而被判定为阳性,未观察到2 个或更多阳性微滴的存在,本研究支持上述结论。在总RNA 量为10 pg时,该体系在月经血中检测出1个miR-888阳性微滴、在阴道分泌液中检测出1 个miR-891a 阳性微滴从而出现假阳性,无法准确鉴别精液。因此,对于只检出1 个阳性微滴的样品,应重复多次检测以进一步验证和分析[15]。
综上所述,本研究建立了双重ddPCR 检测miR-888 和miR-891a 的方法,能够实现对精液的准确鉴别。鉴于法医实际检材微量性的特点,双重ddPCR 检测可以大大节省样品,简化实验流程,缩减检测成本。因此,本研究建立的双重ddPCR 检测体系有望在法医实际案件中进行推广和应用。
猜你喜欢微滴体液双重银墨水/树脂双材料微滴喷射过程数值模拟与分析电子元件与材料(2022年1期)2022-02-14对称Y型分岔微通道微滴分裂数值模拟与实验探究郑州大学学报(工学版)(2022年1期)2022-01-17织物表面导电线路喷射打印中微滴关键参数的视觉测量纺织学报(2021年7期)2021-07-26基于改进分水岭分割算法的致密荧光微滴识别中国光学(2019年4期)2019-09-02化解“双重目标”之困中国外汇(2019年7期)2019-07-13分析师关注对财务重述的双重作用智富时代(2019年2期)2019-04-18分析师关注对财务重述的双重作用智富时代(2019年2期)2019-04-18川木香煨制前后主要药效成分在体外生物体液中稳定性中成药(2018年12期)2018-12-29行政法上的双重尊重行政法论丛(2018年2期)2018-05-21小儿支原体肺炎体液免疫功能与hs-CRP检验的临床意义海南医学(2016年8期)2016-06-08猜你喜欢
- 2024-01-20 有关于第五次全国经济普查统计重点业务综合培训大会上讲话(完整文档)
- 2024-01-20 “严纪律、转作风、保安全、树形象”专题学习教育活动通知(完整文档)
- 2024-01-20 2024XX区住房城乡建设工作情况汇报
- 2024-01-20 2024高校思政教育交流材料:善用反腐败斗争这堂“大思政课”(精选文档)
- 2024-01-20 2024年主题教育专题党课辅导报告,(4)
- 2024-01-20 关于赴某地学习考察地方立法工作情况报告(范文推荐)
- 2024-01-20 2024年度关于增强党建带团建工作实效对策与建议(精选文档)
- 2024-01-20 教师演讲稿:春风化雨育桃李,,潜心耕耘满芬芳(全文)
- 2024-01-20 主题教育第二阶段来了
- 2024-01-20 2024年度关于到信访局实践锻炼个人总结【完整版】
- 搜索
-
- 打赌输了任人处理作文1000字7篇 05-12
- 当代大学生在全面建设社会主义现代化强 05-12
- 全面建成社会主义现代化强国的战略安排 03-10
- 个人廉洁自律方面存在的问题及整改措施 05-12
- 谈谈青年大学生在中国式现代化征程上的 05-12
- 2022年党支部第一议题会议记录(全文完 11-02
- 作为青年大学生如何肩负时代责任6篇 05-12
- 村党组织建设现状及工作亮点存在问题与 05-12
- 全面从严治党,自我革命重要论述研讨会 05-12
- 产业工人队伍建设改革(全文完整) 10-31
- 11-25国庆70周年庆典晚会 庆典晚会串词
- 11-25办公室礼仪的十大原则 浅谈办公室的电话礼仪
- 01-17用心灵轻轻地歌唱_心灵的歌唱
- 01-17也许你不是我一生的唯一|也许不是我
- 01-17爱了,请珍惜;不爱,趁早放手|爱就珍惜不爱就放手
- 01-17岁月带走的是记忆,但回忆会越来越清晰|有趣又有深意的句子
- 01-17曾经的美好只是曾经,我只想珍惜身边的人|我只想珍惜你
- 01-18从容不惊 [学会笑眼去看世界,不惊不乍,淡定从容]
- 02-03当代大学生学习态度调查报告
- 02-03常用护患英语会话
- 标签列表
