首页 > 心得体会 > 学习材料 / 正文
低分子糖-麦醇溶蛋白复合物的结构与性能及其相互作用分析
2023-05-07 14:50:20 ℃杨婷婷,罗国柳,覃小丽,刘雄,钟金锋
(西南大学食品科学学院,重庆 400715)
麦醇溶蛋白(gliadin,Gli)是一种疏水性植物蛋白,因其具有良好的生物相容性、两亲性和可降解性,常作为生物活性成分载体应用于食品领域[1]。然而,分子间相互作用影响了麦醇溶蛋白的结构和性能,进而影响其在食品中的应用[2-4]。有研究发现超声(ultrasonics,U)可诱导蛋白质结构展开,促进蛋白质与配体之间的相互作用,从而影响蛋白质-配体复合物的构象和界面性质[5]。现有研究表明蛋白质和配体之间的相互作用受配体物质分子结构和蛋白质种类的影响[4,6]。因此,阐明不同结构配体物质对麦醇溶蛋白结构的影响及其相互作用机制对提升麦醇溶蛋白加工品质具有重要意义。
低分子糖作为食品加工中广泛使用的小分子物质,具有调节蛋白质构象稳定性和功能性质的作用[7-8]。Huo等[9]探究了6种低分子糖对藻蓝蛋白热稳定性的影响,发现甘露糖对藻蓝蛋白热降解的抑制作用最强。阿拉伯糖(arabinose,Ara)、果糖(fructose,Fru)和海藻糖(trehalose,Tre)是具有多个游离羟基基团的低分子糖,可以作为配体与麦醇溶蛋白结合生成复合物,进而影响麦醇溶蛋白的结构和功能特性。然而,目前与低分子糖-蛋白质复合物相关的研究主要集中在功能特性等宏观性质方面,对于分子层面相互作用机制的研究较少,如何从微观层面阐明二者之间的相互作用机制仍需进一步探讨。分子动力学(molecular dynamics,MD)模拟可从微观层面揭示两原子或分子之间的相互作用,从分子水平阐明复合物的形成机理,为宏观性能指标提供理论支撑[10]。Feng等[11]通过MD模拟发现酚酸与麦醇溶蛋白之间的氢键和疏水相互作用促进了二者的结合。因此,通过MD模拟有助于揭示麦醇溶蛋白与Ara、Fru和Tre之间的相互作用及其复合物性能的调控机制。
本文旨在通过红外光谱、荧光光谱、扫描电镜、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate polyacrylamide gel electrophoresi,SDS-PAGE)电泳分析和乳化性测定考察不同种类低分子糖(Ara、Fru和Tre)与麦醇溶蛋白形成的复合物的结构和性能,并借助MD模拟进一步分析低分子糖与麦醇溶蛋白相互作用的机制,以期为扩大低分子糖与麦醇溶蛋白复合物的应用范围提供理论参考。
1.1 材料与试剂
谷阮粉(蛋白质含量为75.0%):新乡良润全谷物食品有限公司;
麦醇溶蛋白:西南大学食品科学学院实验室自提;
阿拉伯糖(纯度≥99.0%)、果糖(纯度≥98%)、海藻糖(纯度≥98%):合肥博美生物科技有限公司;
其他试剂均为国产分析纯。
1.2 仪器与设备
JY98-IIIDN型超声波细胞粉碎机(探头直径20 mm):宁波新芝生物科技股份有限公司;
FD-1A-50型冷冻干燥机:北京博医康实验仪器有限公司;
Spectrum Two红外光谱仪:美国Perkin-Elmer公司;
F-2500型荧光分光光度计:日本日立公司;
Phenom Pro10102型扫描电镜:荷兰Phenom World公司;
T18 ULTRATURRAX型高速均质机:德国IKA公司;
DF-101S集热式恒温加热磁力搅拌器:巩义市予华仪器有限责任公司;
MX-S可调式漩涡振荡器:大龙兴创实验仪器(北京)有限公司。
1.3 方法
1.3.1 复合物的制备
分别用纯水配制0.1 mol/L阿拉伯糖、果糖和海藻糖溶液,用70%乙醇溶液配制10 mg/mL麦醇溶蛋白溶液,磁力搅拌使其完全混合。取一定量混合液,用纯水定容至300 mL,在300 W下超声处理15 min,超声过程利用冰水浴控制溶液温度在30℃以下,处理完毕后,样品冷冻干燥备用,分别制得超声阿拉伯糖-麦醇溶蛋白复合物(ultrasonics-gliadin-arabinose,U-Gli-Ara)、超声果糖-麦醇溶蛋白复合物(ultrasonics-gliadin-fructose,U-Gli-Fru)和超声海藻糖-麦醇溶蛋白复合物(ultrasonics-gliadin-trehalose,U-Gli-Tre)。
1.3.2 红外光谱的测定
将待测样品与溴化钾以质量比1∶100混合研磨,压制薄片,使用红外光谱仪在波数4 000 cm-1~400 cm-1范围内采集图谱,分辨率为4cm-1,总扫描次数为32次。
1.3.3 荧光光谱的测定
以天然麦醇溶蛋白为对照,使用荧光分光光度计测定超声处理麦醇溶蛋白及其复合物的荧光光谱。固定激发波长为280 nm,激发和发射狭缝宽度均设置为5 nm,扫描范围为300 nm~500 nm。
1.3.4 扫描电镜观察
将待测样品涂于双面导电胶上,在10mA电流下喷金处理后置于扫描电子显微镜样品室,在15kV加速电压扫描观察样品形貌,放大倍数为300倍和1 000倍。
1.3.5 SDS-PAGE分析
参考Cao等[12]的方法略作修改。将0.005 g样品溶解在1 mL上样缓冲液中,沸水浴10 min,冷却至室温(25℃)离心(10 000 r/min,5 min),取 10 μL 样品和预染彩虹蛋白(Marker)分别注入到凝胶泳道中进行电泳。电泳条件:浓缩胶过程电压为80 V,分离胶过程电压为120 V。
1.3.6 乳化活性及乳化稳定性的测定
参考Fan等[13]的方法,取30mL1mg/mL蛋白样液与10 mL大豆油混合,利用均质机进行均质(18 000 r/min,2 min),使两者充分混匀。从底部取出50 μL乳液加入到5 mL 1 mg/mL十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液中,涡旋混匀,立即使用紫外可见分光光度计在500 nm处测量混合溶液的吸光度。根据以下公式计算麦醇溶蛋白及其复合物的乳化活性指数(emulsifying activity index,EAI) 和乳化稳定性指数(emulsifying stability index,ESI)。
式中:2为常数,代表乳液的界面面积是其浊度的2倍;
2.303为ln 10的值;
DF为乳液样品稀释倍数,100;
A0为均质后0 min时的吸光度;
c为乳化前蛋白质样品的浓度,g/mL;
θ为油相的体积分数,0.25;
A10为静置10 min后测得的吸光度;
t为时间,10 min。
1.4 MD模拟
1.4.1 模型的构建
参考Stǎnciuc等[14]同源建模的方法获取麦醇溶蛋白三维结构模型。首先在UniProt数据库中获取麦醇溶蛋白的氨基酸序列(Q9M4L6),然后提交氨基酸序列至I-TASSER服务器[15-16]获取麦醇溶蛋白结构模型,最后采用GROMACS(版本:2019.06)软件进一步退火平衡麦醇溶蛋白模型,选取平衡后的最优构象模型用于后续分子动力学模拟。
从Pubchem数据库中获得阿拉伯糖(ID:10323-20-3)、果糖(ID:136023275)和海藻糖(ID:7427)的初始分子结构模型。
1.4.2 分子动力学模拟参数
以麦醇溶蛋白和阿拉伯糖、果糖、海藻糖分别组成不同复合物结构模型,使用GROMACS(版本:2019.06)软件[17]进行分子动力学模拟,PyMOL(版本:2.4.0a0 open-source)软件进行可视化分析。利用acpype.py[18]调用 Ambertools 18 软件[19],在 glycam06 力场下生成阿拉伯糖、果糖和海藻糖的拓扑文件和坐标文件,并在Amber99SB-ILDN力场下得到麦醇溶蛋白的拓扑和坐标文件。然后,将Gli-Ara、Gli-Fru和Gli-Tre分别封装在立方体盒子中,分子与盒子边缘的距离为1.2 nm,加入TIP3P模型水,通过Na+或Cl-中和体系电荷。在系统能量最小化后,设置pH值为7.0,模拟温度为25℃,并分别运行20 ns,时间步长为2 fs。最后,使用GROMACS软件自带工具计算低分子糖-麦醇溶蛋白复合物的均方根偏差(root mean square deviation,RMSD)和氢键数量;
提取15 ns~20 ns的轨迹,每隔40 ps取一帧,共125帧,采用gmx_mmpbsa工具(https://jerkwin.github.io/gmxtools/)计算低分子糖-麦醇溶蛋白复合物的结合能,其计算公式[20]如下。
式中:ΔGbinding为结合能,kJ/mol;
ΔEele为库仑静电相互作用能,kJ/mol;
ΔEvdw为范德华相互作用能,kJ/mol;
ΔGpolar为极性溶剂化自由能,kJ/mol;
ΔGnonpolar为非极性溶剂化自由能,kJ/mol。
1.5 数据处理
试验均进行3次平行测定,结果以平均值±标准偏差表示。利用SPSS统计软件进行单因素ANOVA分析(p<0.05时为差异显著)。
2.1 红外光谱分析
图 1 为 Gli、U-Gli、U-Gli-Ara、U-Gli-Fru 和 UGli-Tre的红外光谱。

图1 Gli、U-Gli和超声处理复合物的红外光谱Fig.1 Fourier transform infrared spectroscopy of Gli,U-Gli,and ultrasonic treatment complexes
由图1可知,Gli在3402cm-1和1450cm-1~1200cm-1处存在的特征峰分别与O-H伸缩振动和酰胺III带中C-N拉伸和N-H弯曲振动有关[21]。Gli经超声处理后,其在3 402 cm-1处的特征吸收峰红移至3 393 cm-1,表明超声处理使蛋白质分子内氢键发生改变。与U-Gli相比,U-Gli-Ara、U-Gli-Fru和 U-Gli-Tre在 3 393 cm-1处的特征峰发生不同程度的蓝移或者红移(51 cm-1~8 cm-1),表明氢键诱导蛋白质与低分子糖之间的相互作用[22]。同时,U-Gli-Ara复合物在1413cm-1和1241cm-1处的特征峰分别蓝移至1 433 cm-1和1 248 cm-1;
U-Gli-Fru复合物在1 313 cm-1处的特征峰蓝移至1 317 cm-1;
U-Gli-Tre复合物在1 206 cm-1处的特征峰红移至1 200 cm-1,表明低分子糖分别与麦醇溶蛋白的C-N基团和N-H基团发生相互作用。
2.2 荧光光谱分析
荧光光谱可反映蛋白质的构象变化,因此采用荧光光谱研究麦醇溶蛋白与低分子糖配体之间的相互作用及复合物结构变化。图2为Gli、U-Gli、U-Gli-Ara、U-Gli-Fru和U-Gli-Tre的内源荧光光谱。

图2 Gli、U-Gli和超声处理复合物的荧光光谱Fig.2 Fluorescence spectra of Gli,U-Gli,and ultrasonic treatment complexes
由图2可知,Gli在334 nm处具有最大荧光发射峰,经超声处理后,荧光强度增加,表明麦醇溶蛋白分子部分变性,蛋白质结构展开[23]。同时,U-Gli-Ara、UGli-Fru和U-Gli-Tre的荧光强度高于U-Gli,这可能是由于Gli与低分子糖之间发生相互作用,导致Gli结构发生改变,还可能是低分子糖覆盖在Gli表面,阻止了发色基团的暴露,这与Hu等[24]的研究结果一致。此外,U-Gli-Tre复合物的荧光强度明显高于U-Gli-Ara和U-Gli-Fru,这可能是由于海藻糖羟基基团较多,与麦醇溶蛋白的亲和力更强。
2.3 扫描电镜分析
图 3 为 Gli、U-Gli、U-Gli-Ara、U-Gli-Fru 和 UGli-Tre的扫描电镜图。

图3 Gli、U-Gli和超声处理复合物的扫描电镜Fig.3 Scanning electron micrograph of Gli,U-Gli,and ultrasonic treatment complexes
由图3A可知,Gli呈现出许多不规则的片段、小间隙和大的球形聚集体,经超声处理后,U-Gli表现为孔洞状结构半球形结构(图3B),这可能是由于超声处理削弱了蛋白质分子内氢键和范德华力,导致麦醇溶蛋白形态变得松散多孔,其构象和二级结构发生变化[25];
与U-Gli相比,U-Gli-Ara表面孔径变得细小,样品纹理松散,呈现出蜂窝状(图3C);
U-Gli-Fru表面球形聚集体形状变小,且呈现出大量小的聚集体(图3D);
UGli-Tre出现连续的蜂窝状网络结构(图3E),表明低分子糖的引入可以抑制麦醇溶蛋白分子的聚集[26]。
2.4 SDS-PAGE分析
通过分析SDS-PAGE探究低分子糖-麦醇溶蛋白复合物的分子量及蛋白质亚基组成变化。图4为聚丙烯酰胺凝胶电泳图。

图4 Gli、U-Gli和超声处理复合物的SDS-PAGE图谱Fig.4 SDS-PAGE of Gli,U-Gli,and ultrasonic treatment complexes
由图4可知,α/β-麦醇溶蛋白分子量分布在30 kDa~35 kDa[27],Gli在35 kDa左右呈现出相应的特征带(泳道2)。同样,U-Gli(泳道3)与Gli(泳道2)在约34 kDa处出现类似条带,表明超声处理对蛋白质分子量无明显影响。此外,U-Gli-Ara(泳道 4)、U-Gli-Fru(泳道 5)和U-Gli-Tre(泳道6)的条带与U-Gli(泳道3)相比无明显变化,即没有观察到蛋白质亚基的降解,分子量均在34 kDa左右,说明低分子糖不是通过降解麦醇溶蛋白分子来影响蛋白质结构[28]。
2.5 乳化性能分析
乳化性作为重要的功能性质之一,与蛋白质的两亲性和分子结构特征有关[23]。EAI和ESI是反映蛋白质形成油水界面乳状液层能力和乳状液稳定性的重要指标。图 5 为 Gli、U-Gli、U-Gli-Ara、U-Gli-Fru 和U-Gli-Tre的EAI和ESI结果。

图 5 Gli、U-Gli、U-Gli-Ara、U-Gli-Fru 和 U-Gli-Tre 乳化性Fig.5 Emulsifying properties of Gli,U-Gli,U-Gli-Ara,UGli-Fru,and U-Gli-Tre
由图5可知,U-Gli的EAI和ESI分别为37.3 m2/g和14.2 min,较Gli分别提高了15.4%和7.6%,表明超声处理可以改善麦醇溶蛋白的乳化性能。这可能是因为超声处理后,蛋白质聚集体尺寸减小,使其在油水界面的吸附能力增强[29]。此外,U-Gli-Ara、U-Gli-Fru和U-Gli-Tre的EAI较U-Gli分别增加了约4.8%、5.0%和22.9%,ESI分别增加了约17.0%、31.1%和34.8%。表明低分子糖的引入可以进一步提高麦醇溶蛋白的乳化性。这可能是由于复合物的结构展开,有利于快速吸附到油水界面,并且羟基基团的增加提高了蛋白质的亲水性[30]。
2.6 MD模拟
2.6.1 RMSD分析
RMSD能够反映复合物在模拟过程中的构象偏离其初始构象的程度[31]。通过分析低分子糖-麦醇溶蛋白复合物中蛋白质骨架原子的RMSD随时间的变化趋势,以考察模拟过程中复合物体系的稳定程度。图6为Gli-Ara、Gli-Fru和 Gli-Tre在 MD模拟过程中的RMSD变化。

图6 Gli-Ara、Gli-Fru和Gli-Tre在MD模拟过程中的RMSD变化Fig.6 RMSD changes of Gli-Ara,Gli-Fru,and Gli-Tre during MD simulation
由图6可知,在0~15 ns范围内,3种低分子糖与麦醇溶蛋白复合物的RMSD波动较大,且随着低分子糖链长的增加,RMSD逐渐升高;
在15 ns以后,三者逐渐趋于平稳,此时Gli-Ara、Gli-Fru和Gli-Tre的RMSD分别维持在0.36、0.45 nm和0.56 nm左右,RMSD曲线波动幅度变小,表明所有复合物体系稳定,可用于进一步分析氢键和结合能变化。
2.6.2 氢键分析
分子间氢键对蛋白质-配体之间的相互作用有重要贡献,且对维持复合物的稳定性有重要意义[32-33]。图7为不同复合物(Gli-Ara、Gli-Fru和Gli-Tre)在MD模拟过程中形成的氢键数量随时间的变化。
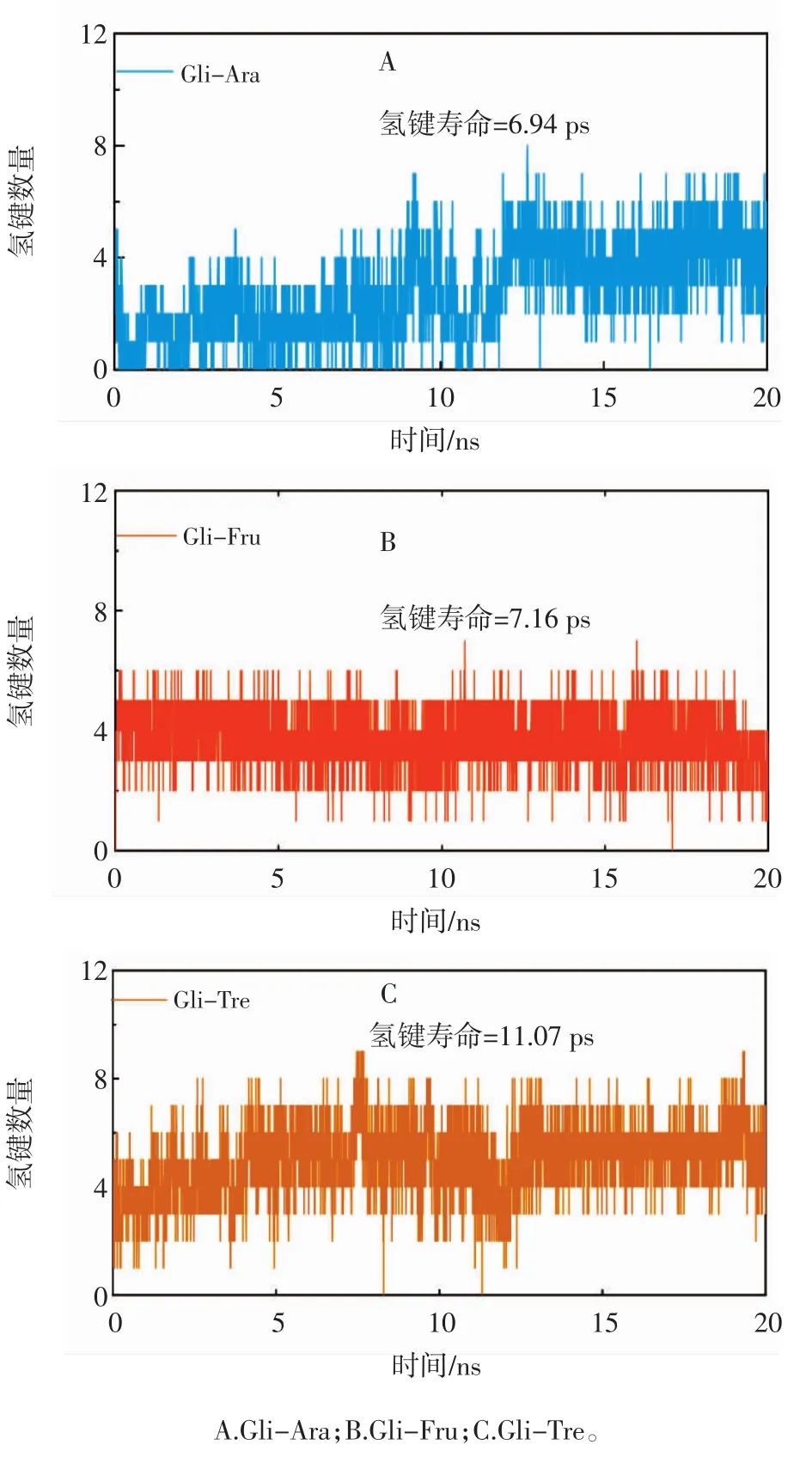
图7 Gli-Ara、Gli-Fru和Gli-Tre在MD模拟过程中氢键数目的变化Fig.7 Changes in the number of hydrogen bonds in Gli-Ara,Gli-Fru,and Gli-Tre during MD simulations
由图7可知,在MD模拟达到平衡后(15ns~20ns),Gli-Ara、Gli-Fru和Gli-Tre复合物的平均氢键寿命分别为 6.94、7.16 ps和 11.07 ps,且 Gli-Ara、Gli-Fru 和Gli-Tre在大多数时间内分别出现4、4个和6个氢键,这可能是由于海藻糖分子羟基基团与麦醇溶蛋白形成了更多的分子间氢键,有利于维持复合物体系的稳定性,这与红外光谱的结果一致(图1)。
2.6.3 结合能分析
分子间结合能可用于衡量蛋白质和配体分子间结合亲和力,结合能越低,复合物构象相对越稳定[32,34]。图8为在MD模拟平衡时间段内,Gli-Ara、Gli-Fru和Gli-Tre复合体系中各项能量的贡献情况。

图8 Gli-Ara、Gli-Fru和Gli-Tre在MD模拟过程中能量的变化Fig.8 Energy changes of Gli-Ara,Gli-Fru,and Gli-Tre during MD simulation
由图8可知,Gli-Tre复合物的结合能(-40.6kJ/mol)低于Gli-Fru复合物(-15.2 kJ/mol)和Gli-Ara复合物(-9.9 kJ/mol),表明Gli-Tre复合物比Gli-Fru复合物及Gli-Ara复合物更稳定,这与超声处理后的Gli-Tre复合物的ESI高于Gli-Fru复合物与Gli-Ara复合物的结果一致(图5)。此外,库仑静电相互作用能的变化趋势与范德华相互作用能相似,且后者表现为更低的负值,这与Katouzian等[35]研究发现氢键和范德华相互作用是驱动α-乳清蛋白与橄榄苦苷结合的主要作用力的结果一致,表明范德华力对维持麦醇溶蛋白与低分子糖形成的复合物的稳定性起主要作用,而3种复合物的极性溶剂化自由能均为正值,表明极性溶剂化自由能是阻碍低分子糖与麦醇溶蛋白结合的主要因素。
本文研究了不同种类低分子糖对其与麦醇溶蛋白形成的复合物结构、稳定性及相互作用机制的影响。结果表明,海藻糖-麦醇溶蛋白复合物的EAI和ESI较麦醇溶蛋白分别增加了约22.9%和34.8%,表现出最佳的乳化性;
红外光谱表明阿拉伯糖、果糖和海藻糖与麦醇溶蛋白之间存在氢键相互作用。此外,分子动力学模拟表明氢键与范德华力是驱动低分子糖和麦醇溶蛋白形成复合物的主要作用力,且海藻糖-麦醇溶蛋白复合物形成了更多的分子间氢键(6个)和更低的结合能(-40.6 kJ/mol),有利于维持体系稳定性。综上,本文为提升麦醇溶蛋白加工品质以及进一步研究低分子糖-麦醇溶蛋白复合性能提供理论参考。
- 上一篇:基于电商发展的林芝天麻营销策略创新
- 下一篇:4种粽叶多酚提取物对草鱼片的保鲜效果
猜你喜欢
- 2024-01-20 有关于第五次全国经济普查统计重点业务综合培训大会上讲话(完整文档)
- 2024-01-20 “严纪律、转作风、保安全、树形象”专题学习教育活动通知(完整文档)
- 2024-01-20 2024XX区住房城乡建设工作情况汇报
- 2024-01-20 2024高校思政教育交流材料:善用反腐败斗争这堂“大思政课”(精选文档)
- 2024-01-20 2024年主题教育专题党课辅导报告,(4)
- 2024-01-20 关于赴某地学习考察地方立法工作情况报告(范文推荐)
- 2024-01-20 2024年度关于增强党建带团建工作实效对策与建议(精选文档)
- 2024-01-20 教师演讲稿:春风化雨育桃李,,潜心耕耘满芬芳(全文)
- 2024-01-20 主题教育第二阶段来了
- 2024-01-20 2024年度关于到信访局实践锻炼个人总结【完整版】
- 搜索
-
- 打赌输了任人处理作文1000字7篇 05-12
- 当代大学生在全面建设社会主义现代化强 05-12
- 全面建成社会主义现代化强国的战略安排 03-10
- 个人廉洁自律方面存在的问题及整改措施 05-12
- 谈谈青年大学生在中国式现代化征程上的 05-12
- 2022年党支部第一议题会议记录(全文完 11-02
- 作为青年大学生如何肩负时代责任6篇 05-12
- 村党组织建设现状及工作亮点存在问题与 05-12
- 全面从严治党,自我革命重要论述研讨会 05-12
- 产业工人队伍建设改革(全文完整) 10-31
- 11-25国庆70周年庆典晚会 庆典晚会串词
- 11-25办公室礼仪的十大原则 浅谈办公室的电话礼仪
- 01-17用心灵轻轻地歌唱_心灵的歌唱
- 01-17也许你不是我一生的唯一|也许不是我
- 01-17爱了,请珍惜;不爱,趁早放手|爱就珍惜不爱就放手
- 01-17岁月带走的是记忆,但回忆会越来越清晰|有趣又有深意的句子
- 01-17曾经的美好只是曾经,我只想珍惜身边的人|我只想珍惜你
- 01-18从容不惊 [学会笑眼去看世界,不惊不乍,淡定从容]
- 02-03当代大学生学习态度调查报告
- 02-03常用护患英语会话
- 标签列表
