首页 > 心得体会 > 学习材料 / 正文
PMA-qPCR方法快速检测细菌性果斑病菌活菌的研究
2023-05-08 18:05:15 ℃郝芳敏, 丁伟红, 马二磊, 严蕾艳, 黄芸萍, 王毓洪, 臧全宇
(宁波市农业科学研究院 宁波瓜菜育种重点实验室, 浙江 宁波 315040)
细菌性果斑病(bacterial fruit blotch,BFB)由西瓜噬酸菌Acidovoraxcitrulli引起[1],是在全球范围内危害西甜瓜产业的一种毁灭性细菌病害。该病害在西甜瓜整个生育期都能发生,西甜瓜的叶片、果实和幼茎都会受害,病害发生初期表现为叶片出现水渍状斑点,随后病斑扩大变为褐色坏死病斑,最后致整个叶片枯萎;
果实受侵染会出现水浸状凹陷斑点,严重时果实出现腐烂并致使种子带菌[2],对西甜瓜产业造成了极为严重的产量和经济损失。
细菌性果斑病是典型的种传细菌性病害[3],是我国的植物检疫性病害,防治细菌性果斑病最有效的方法是生产和使用无菌种子,使用健康种子可以有效的降低果斑病的暴发风险[4]。因此,建立一套快速、简便、灵敏的检测方法是当务之急。当前国内外对于细菌性果斑病的检测方法包括免疫富集PCR[5-6]、环介导等温扩增(LAMP)[7]、免疫磁性分离PCR[8-9]、免疫凝聚试纸条[10]、实时荧光定量PCR[11]等方法。然而以上方法,均不能区分检测到的细菌性果斑病菌是活菌还是死菌,容易出现假阳性,因此,急需建立一种快速有效检测样品中细菌性果斑病菌活菌的方法。叠氮溴化丙锭(propidium monoazide,PMA)是一种特异性的活性染料,在强光下与死细胞DNA进行不可逆的共价结合,阻碍死细胞DNA进行PCR扩增[12]。使用PMA对菌悬浮液进行预处理后提取该DNA,结合qPCR进行扩增。qPCR扩增后的Ct值为活细胞的Ct值,排除了死细胞的干扰[13]。
本研究以细菌性果斑病菌的定量检测为出发点,利用PMA对活/死细胞具有选择性的特性,结合荧光定量PCR进行细菌性果斑病菌的检测。对PMA作用于细菌性果斑病菌的最佳浓度及曝光时间进行摸索,然后对田间的西甜瓜种子进行细菌性果斑病菌的活菌检测,旨在建立一种快速、灵敏、特异性强且可定量检测细菌性果斑病菌的方法。
1.1 供试菌株
供试Acidovoraxcitrulli菌株pslbtw36由中国农业科学院植物保护研究所赵廷昌研究员馈赠,供试甜瓜种子材料为田间随机收集的西州蜜25种子。
供试菌株在LA培养基上活化,置于28 ℃培养箱24 h,挑单菌落于LB液体培养基,28 ℃摇培12 h。
1.2 实时荧光定量PCR标准曲线绘制
本研究采用探针法荧光定量PCR进行检测[14],上游引物A.citrulli-FP:5′-CTGATAATCCTCGGC TCAACAA-3′;
下游引物A.citrulli-RP:5′-TGA GCGCATTTCTGACGAG-3′;
探针A.citrulli-P:FAM-AAGAAATACGCCCTCGCCAATCTCC-BHQ1[14],对菌株pslbtw36的基因组DNA进行荧光定量PCR检测,扩增片段大小为121 bp,符合实时荧光定量PCR的扩增条件。将A.citrulli菌株pslbtw36基因组DNA按10倍梯度依次稀释至30 ng·μL-1、3 ng·μL-1、300 pg·μL-1、30 pg·μL-1、3 pg·μL-1、300 fg·μL-1、30 fg·μL-1和3 fg·μL-1,直接取稀释后的1 μL基因组DNA进行荧光定量PCR扩增,每个浓度3次重复,PCR反应体系:1 μL DNA模板、0.4 μL正向引物A.citrulli-FP(20 μmol·L-1)、0.4 μL反向引物A.citrulli-RP(20 μmol·L-1)、10 μL 2×TransStart® Tip Green qPCR SuperMix(全式金,北京)、0.4 μL Passive Reference Dye Ⅱ,用ddH2O定容至20 μL,在PCR仪中进行扩增。PCR反应程序:94 ℃预变性30 s;
94 ℃变性5 s,50 ℃退火30 s,扩增40个循环。荧光定量PCR扩增完成后,根据Ct值与其相对应的基因组DNA浓度对数值构建线性回归方程,以基因组DNA浓度的对数值为横坐标,Ct值为纵坐标,建立标准曲线。
1.3 PMA-qPCR样品前处理
PMA的配制:将PMA在黑暗条件下溶于二甲基亚砜(DMSO)溶液,配制成1 mg·mL-1的母液,用锡箔纸包裹置于-20 ℃避光保存备用。
细菌性果斑病菌活菌和死菌的制备:将新鲜A.citrulli菌悬液浓度调至1×107mL-1,并将菌悬液平均分为2份,一份静置备用,另一份置于100 ℃水浴10 min进行热致死,并取100 μL热致死的菌悬液涂布于LA固体培养基上,置于28 ℃培养箱48 h,验证热致死效果后备用。
PMA处理:将PMA在避光条件下加入菌悬液中,轻微振荡混匀,在黑暗中静置10 min,再将菌液取出开盖置于冰上,距离灯管15 cm,650 W卤钨灯持续曝光10 min使PMA光解。将处理后的菌悬液置于100 ℃水浴锅加热10 min以释放DNA,再作为模板进行荧光定量PCR检测。
1.4 病原菌活细胞对PMA染料的耐受能力测定
将PMA避光加入到含有500 μL浓度为1×107mL-1细菌性果斑病菌A.citrulli活细胞菌悬液的1.5 mL离心管中,使PMA的终浓度分别为0、0.5、1、3、6、9、12和24 μg·mL-1,并按照1.3做PMA的静置、曝光处理,进行荧光定量PCR检测。
1.5 实时荧光定量PCR反应中PMA抑制死细胞的最低浓度测定
将PMA避光加入到含有500 μL浓度为1×107mL-1的细菌性果斑病菌A.citrulli死细胞菌悬液的1.5 mL离心管中,使PMA的终浓度分别为0、0.5、1、3、6、9、12和24 μg·mL-1,并按照1.3做PMA的静置、曝光处理,进行荧光定量PCR检测。
1.6 不同曝光时间对PMA处理效果的影响
PMA染料的作用原理是在高强度的可见光曝光处理后,可与死细胞DNA进行不可逆的共价结合,阻碍死细胞DNA进行PCR扩增。为研究不同曝光时间对PMA处理效果的影响,将PMA分别避光加入到含有500 μL浓度为1×107mL-1细菌性果斑病菌A.citrulli死细胞和活细胞菌悬液的1.5 mL离心管中,使PMA的终浓度为9 μg·mL-1(经过筛选出的最适浓度),按照1.3节做PMA的静置、曝光处理,分别将曝光时间设为0、1、3、5、8、10、15 min,并将处理后的菌悬液进行荧光定量PCR检测。
1.7 死、活细胞混合体系的PMA-qPCR检测
为验证PMA-qPCR具有区分活、死细胞的能力,将PMA-qPCR用于检测不同比例的死、活细胞混合液。将新鲜的细菌性果斑病菌A.citrulli配制成浓度为1×106mL-1的菌悬液,并于100 ℃水浴10 min进行热致死,并分别加入不同浓度的新鲜活体菌悬液,使活细胞浓度占菌悬液总浓度的不同比例。活、死细胞菌悬液按照1×105∶1×105、1×104∶1×105、1×103∶1×105、1×102∶1×105、1×101∶1×105、1×100∶1×105、1×10-1∶1×105、1×10-2∶1×105等体积混合均匀后,分别用传统的荧光定量PCR和PMA-qPCR检测。PMA-qPCR需要在混合后的菌悬液中避光加入PMA,使PMA的终浓度为9 μg·mL-1(经过筛选出的最适浓度),按照1.3节做PMA的静置、曝光处理,并进行荧光定量PCR检测。
1.8 PMA-qPCR检测的假阳性验证
将新鲜的细菌性果斑病菌A.citrulli配制成浓度为1×104、1×103、1×102、1×101、1×100、1×10-1mL-1和1×10-2mL-1的菌悬液,在100 ℃水浴10 min进行热致死,分别采用传统荧光定量PCR、PMA-qPCR和平板培养计数法进行检测。PMA-qPCR需要在菌悬液中避光加入PMA,使PMA的终浓度为9 μg·mL-1(经过筛选出的最适浓度),按照1.3节做PMA的静置、曝光处理,并将处理后的菌悬液进行荧光定量PCR检测。
1.9 自然感染甜瓜种子的PMA-qPCR检测
为评估PMA-qPCR法在田间自然感染的甜瓜种子的检测效果,从田间收集不同材料的甜瓜种子进行检测。首先每份材料取300 g的种子用pH值7.0的0.01 mol·L-1的磷酸缓冲液浸没,室温振荡4 h(100 r·min-1),再4 ℃浸泡过夜,再将浸泡液1 000 r·min-1离心1 min,去沉淀,上清液10 000 r·min-1离心10 min,弃上清,取沉淀,用无菌水进行悬浮,制成需要体积的悬浮液。取上清置于新的1.5 mL离心管中,分为a、b、c 3份。a组不做处理,直接进行qPCR检测,b组用终浓度为9 μg·mL-1的PMA处理,并进行静置、曝光,再进行qPCR检测,c组置于100 ℃水浴10 min进行热致死处理,加入终浓度为9 μg·mL-1的PMA静置、曝光处理,之后进行qPCR检测。所有样品均要进行细菌性果斑病的选择培养基EBBA平板分离培养。
2.1 实时荧光定量PCR的灵敏度检测及标准曲线绘制
将细菌性果斑病菌A.citrulli基因组DNA浓度调至30 ng·μL-1,进行10倍梯度稀释,使浓度范围依次为30 ng·μL-1、3 ng·μL-1、300 pg·μL-1、30 pg·μL-1、3 pg·μL-1、300 fg·μL-1、30 fg·μL-1和3 fg·μL-1。分别取1 μL不同浓度的基因组DNA作为模板进行荧光定量PCR扩增。结果表明,当DNA浓度>300 fg·μL-1时,荧光定量PCR扩增Ct值均小于35,当浓度<300 fg·μL-1时,Ct值大于35,为无效值(图1)。所以认为荧光定量PCR的检测下限为300 fg·μL-1,以A.citrulli基因组DNA浓度的对数值为横坐标,Ct值为纵坐标,建立回归方程,回归方程为y=-3.255 9x+44.614,相关系数R2=0.997 9,线性关系良好,因此,在后期研究中可根据荧光定量PCR的Ct值来计算检测样品对应的基因组DNA浓度。

图1 荧光定量PCR扩增Acidovorax citrulli基因组DNA的标准曲线
2.2 抑制死细胞qPCR扩增的PMA最适浓度优化
根据PMA阻碍死细胞DNA进行PCR扩增的原理,进行PMA处理死细胞DNA的浓度筛选,既可抑制死细胞DNA的扩增,又不会影响活细胞DNA的扩增。首先将细菌性果斑病菌A.citrulli菌悬液浓度调至1×107mL-1,一组做热致死处理,另一组不做处理,分别加入不同浓度的PMA预处理,并进行qPCR扩增。结果表明,当PMA终浓度≤12 μg·mL-1时,A.citrulli活细胞DNA的qPCR扩增Ct值与不加PMA初始对照之间无显著差异(图2);
当PMA终浓度≥9 μg·mL-1时,A.citrulli死细胞DNA的qPCR扩增Ct值不再显著升高(图3)。因此,当PMA终浓度为9 μg·mL-1时,既能完全抑制A.citrulli菌悬液死细胞DNA扩增,又对活细胞DNA扩增无显著影响,表明PMA浓度为9 μg·mL-1时,可作为PMA-qPCR检测区分A.citrulli的纯培养死、活细胞的最适浓度。
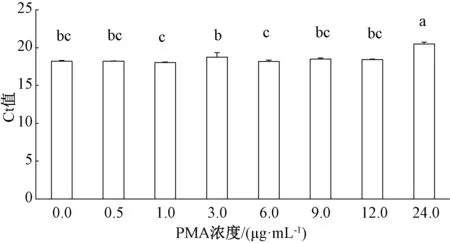
柱上无相同字母者表示差异明显(P<0.05),图3~5同。图2 不同浓度PMA对细菌性果斑病菌活细胞DNA荧光定量PCR扩增的影响

图3 不同浓度PMA对细菌性果斑病菌死细胞DNA荧光定量PCR扩增的影响
2.3 PMA最佳曝光时间优化
根据PMA在强光下与死细胞DNA进行不可逆的共价结合,阻碍死细胞DNA进行PCR扩增的原理,通过设置不同的曝光时间来筛选PMA预处理最佳的曝光时间。结果表明,当曝光时间从1 min逐渐延长至15 min时,PMA对活细胞DNA的qPCR扩增均无影响(图4);
而PMA对死细胞处理中,当曝光时间为8 min时,可完全抑制死细胞DNA的qPCR扩增,Ct值不再发生变化(图5)。因此,本研究中PMA染料的曝光最佳时间为8 min,PMA的最适浓度为9 μg·mL-1,可完全抑制1×107mL-1细菌性果斑病菌A.citrulli菌悬液死细胞DNA的扩增,且对活细胞DNA的扩增无显著影响。

图4 不同PMA曝光时间对细菌性果斑病菌活细胞DNA荧光定量PCR扩增的影响

图5 不同PMA曝光时间对细菌性果斑病菌死细胞DNA荧光定量PCR扩增的影响
2.4 混合体系中PMA-qPCR对活细胞的选择性扩增
将细菌性果斑病菌A.citrulli死细胞(1×105mL-1)与不同浓度活细胞等体积混合均匀,加入终浓度为9 μg·mL-1的PMA处理后进行qPCR扩增。随着活细胞比例下降,Ct值呈现逐渐增加的趋势,检测下限可达到1×103mL-1活细胞(图6)。未经PMA处理的死、活细胞混合体系直接进行qPCR扩增,无论活细胞比例如何变化,其qPCR扩增的Ct值始终维持在一个稳定水平,无显著变化。因此,PMA-qPCR可以有效区分细菌性果斑病菌A.citrulli菌悬液中的死、活细胞,能够选择性的对活细胞DNA进行扩增,而传统的qPCR无法区分死、活细胞,其检测结果会对体系中的活细胞数目造成一定程度的高估。在活菌为2.0×101~2.0×106,其菌数与Ct值呈线性相关,回归方程为y=-2.706 4x+43.404,相关系数为R2=0.982 7(图7)。因此,可根据荧光定量PCR的Ct值来快速定量测定样品对应的活菌数。

柱上无相同大写字母表示未加PMA处理间差异极显著(P<0.01);
柱上无相同小写字母表示加PMA处理间差异显著(P<0.05)。图6 活、死细胞混合体系中PMA-qPCR的选择性扩增

图7 PMA-qPCR扩增A. citrulli活菌细胞数的标准曲线
2.5 PMA-qPCR检测的假阳性验证
为验证PMA-qPCR检测方法对细菌性果斑病菌A.citrulli死细胞的检测是否会出现假阳性结果,将死细胞菌悬液设置8组不同浓度,分别进行传统荧光定量PCR、PMA-qPCR和平板培养计数法检测。结果表明,当用PMA-qPCR和平板培养计数法检测8组灭活死细胞时,检测结果均为阴性;
而用传统的荧光定量PCR检测时,均能够检测到细菌性果斑病菌的存在(表1)。因此,在细菌性果斑病菌A.citrulli的死细胞DNA的检测中,传统的荧光定量PCR不能有效区分死、活细胞,而PMA-qPCR法仅能扩增活细胞的DNA,未出现假阳性扩增结果;
且使用平板培养计数法进一步验证了PMA-qPCR的可靠性。
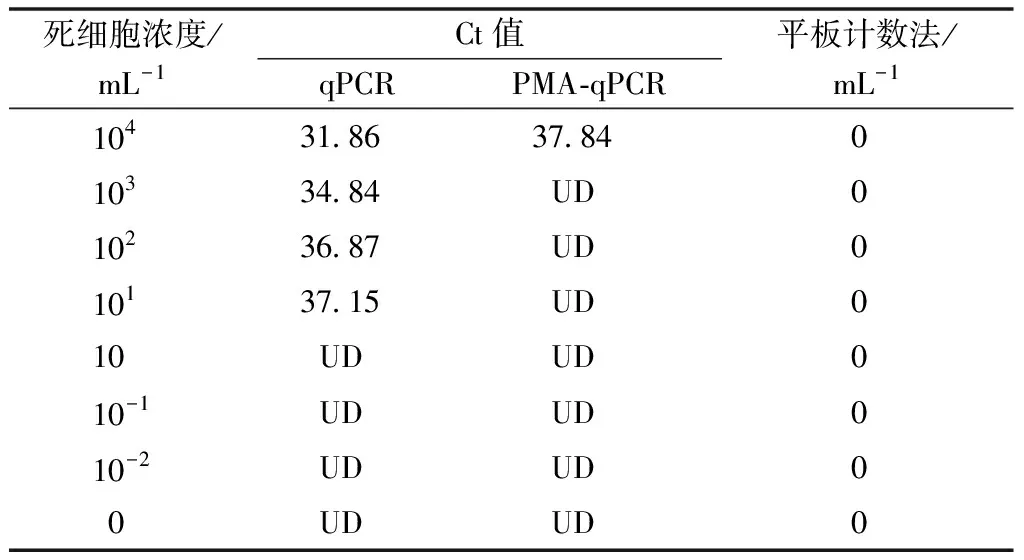
表1 不同方法对细菌性果斑病菌死细胞检测效果比较
2.6 田间甜瓜种子的PMA-qPCR检测
使用PMA-qPCR检测采集的10份甜瓜种子样品,结果表明,待测样品中有5份可检测到细菌性果斑病菌A.citrulli,其Ct在19.46~33.64;
将5份样品活菌浓度换算为所对应的基因组DNA浓度,为0.023~91.2 ng·μL-1,活菌个数在1.1~3.6 mL-1。采用平板分离培养法检测这5份带有果斑病菌活菌的样品,均能分离到A.citrulli,验证了PMA-qPCR检测的准确性。同时,用传统qPCR法可检测到6份甜瓜种子带有果斑病菌A.citrulli。这10份样品进行热致死处理,用PMA-qPCR检测后发现所有检测结果均为阴性(表2)。因此,PMA-qPCR可快速准确地检测甜瓜种子样品中果斑病菌的活体状态,从而代替平板分离培养法。

表2 田间甜瓜种子样品的PMA-qPCR检测
瓜类细菌性果斑病是世界性检疫性细菌病害,在全世界范围内普遍发生,目前已成为影响我国瓜类生产的主要病害之一,具有发病迅速、传播速度快、防病难等特点,可造成我国瓜类生产上巨大的经济损失,一旦发病将难以控制,该病原菌可通过伤口和气孔侵染瓜类子叶和果实[15],可通过种子携带传播,是一种种传病害,因此,需在种子源头上进行检测,以减少因种传造成的损失。
近年来,PMA-qPCR技术已被广泛应用于多种细菌的活死菌的鉴别检测,肖妍等[16]建立的PMA-qPCR技术能有效地用于陕西猕猴桃溃疡菌的活死菌检测,王帅等[17]建立了一种适于青枯菌不同小种菌株活细胞快速检测的PMA-qPCR方法。Tian等[14]在细菌性果斑病菌A.citrulli建立的PMA-qPCR活菌检测技术,确立了PMA终浓度为3 μg mL-1曝光时间为5 min的PMA体系,能有效抑制1.0×106mL-1灭活死菌的扩增,对活菌的扩增没有影响,检测活菌的阈值为1.0×103mL-1。本试验以细菌性果斑病菌A.citrulli为研究对象,通过优化PMA处理条件,实现检测浙江地区细菌性果斑病菌A.citrulli活菌的目的。结果表明,PMA终浓度为9 μg·mL-1,最佳曝光时间为8 min的PMA预处理体系,能有效抑制1.0×107mL-1灭活死菌的扩增,对活菌的扩增没有影响,相较于Tian等[14]的研究,增加了10倍死菌的检测范围。当活菌数在2.0×101~2.0×106mL-1内,qPCR反应体系中活菌数与Ct值呈线性相关(R2=0.982 7),相较于Tian等[14]的研究,检测活菌的阈值从1.0×103mL-1下降到2.0×101mL-1,可以更加有效地检测细菌性果斑病菌的活死菌。
本文建立的PMA-qPCR方法可在一定范围内有效去除细菌性果斑病死菌的干扰,定量检测出活菌数量,研究结果可为植物细菌性果斑病的流行规律研究提供新的技术支撑,为细菌性果斑病活菌检测提供了科学的参考依据,并能有效避免PCR检测实际样品可能造成的假阳性结果,为瓜类繁殖材料的带菌检测与细菌性果斑病防控效果评价提供可靠的技术支撑。
猜你喜欢活菌悬液细菌性运用OD值法快速进行乳酸菌活菌计数的研究现代畜牧科技(2021年3期)2021-07-21细菌性食物中毒事件调查研究健康体检与管理(2021年10期)2021-01-03基于羊细菌性疾病的预防控制分析湖北农机化(2020年4期)2020-07-24预防细菌性食物中毒的主要方法娃娃乐园·综合智能(2019年12期)2020-01-15磺胺嘧啶银混悬液在二度烧伤创面治疗中的应用武警医学(2018年10期)2018-11-06薯蓣皂苷元纳米混悬液的制备中成药(2017年9期)2017-12-19细菌性肝脓肿64例诊治分析川北医学院学报(2015年5期)2015-12-05雾化吸入布地奈德混悬液治疗COPD急性加重期的效果观察中国当代医药(2015年20期)2015-03-01双歧三联活菌联合硝苯地平治疗腹泻型肠易激综合征的临床效果中国当代医药(2015年20期)2015-03-01双歧杆菌三联活菌联合多潘立酮治疗新生儿喂养不耐受40例中国药业(2014年19期)2014-05-17猜你喜欢
- 2024-01-20 有关于第五次全国经济普查统计重点业务综合培训大会上讲话(完整文档)
- 2024-01-20 “严纪律、转作风、保安全、树形象”专题学习教育活动通知(完整文档)
- 2024-01-20 2024XX区住房城乡建设工作情况汇报
- 2024-01-20 2024高校思政教育交流材料:善用反腐败斗争这堂“大思政课”(精选文档)
- 2024-01-20 2024年主题教育专题党课辅导报告,(4)
- 2024-01-20 关于赴某地学习考察地方立法工作情况报告(范文推荐)
- 2024-01-20 2024年度关于增强党建带团建工作实效对策与建议(精选文档)
- 2024-01-20 教师演讲稿:春风化雨育桃李,,潜心耕耘满芬芳(全文)
- 2024-01-20 主题教育第二阶段来了
- 2024-01-20 2024年度关于到信访局实践锻炼个人总结【完整版】
- 搜索
-
- 打赌输了任人处理作文1000字7篇 05-12
- 当代大学生在全面建设社会主义现代化强 05-12
- 全面建成社会主义现代化强国的战略安排 03-10
- 个人廉洁自律方面存在的问题及整改措施 05-12
- 谈谈青年大学生在中国式现代化征程上的 05-12
- 2022年党支部第一议题会议记录(全文完 11-02
- 作为青年大学生如何肩负时代责任6篇 05-12
- 村党组织建设现状及工作亮点存在问题与 05-12
- 全面从严治党,自我革命重要论述研讨会 05-12
- 产业工人队伍建设改革(全文完整) 10-31
- 11-25国庆70周年庆典晚会 庆典晚会串词
- 11-25办公室礼仪的十大原则 浅谈办公室的电话礼仪
- 01-17用心灵轻轻地歌唱_心灵的歌唱
- 01-17也许你不是我一生的唯一|也许不是我
- 01-17爱了,请珍惜;不爱,趁早放手|爱就珍惜不爱就放手
- 01-17岁月带走的是记忆,但回忆会越来越清晰|有趣又有深意的句子
- 01-17曾经的美好只是曾经,我只想珍惜身边的人|我只想珍惜你
- 01-18从容不惊 [学会笑眼去看世界,不惊不乍,淡定从容]
- 02-03当代大学生学习态度调查报告
- 02-03常用护患英语会话
- 标签列表
