首页 > 心得体会 > 学习材料 / 正文
TAZ蛋白在血管紧张素Ⅱ诱导的人脐静脉内皮细胞MCP-1表达中的作用研究
2023-01-16 17:25:07 ℃卓坤萍 姚阳 周明生 徐茜
高血压是危害人类健康的常见病,长期未控制的高血压可引起心、脑、肾、血管等并发症[1-2]。高血压血管损伤发病机制非常复杂,90%左右的高血压患者发病原因不明(原发性高血压),这是制约人们能够有效预防和治疗高血压并降低心脑血管并发症的主要因素[3]。尽管进行了广泛的研究,目前对高血压血管疾病的发病机制仍然没有完全清楚。高血压发病机制复杂,关于高血压发病机制的研究众多,例如肾素—血管紧张素—醛固酮系统紊乱、氧化应激以及血管内皮功能损伤等。血管内皮功能损伤和免疫损伤均被认为与高血压的发生相关[4]。内皮细胞激活后分泌的促炎性细胞因子如MCP-1,vascular cell adhesion molecule-1(VCAM-1)等可以募集单核巨噬细胞向血管壁浸润从而加速血管损伤。近期研究表明血液流动模式可影响血管内皮细胞Hippo 信号通路,血流由层流转变为湍流可激活血管内皮细胞Hippo 下游关键信号分子Yes-associated protein 1(YAP1)/TAZ,促进血管炎症的发生并加剧动脉粥样硬化过程,而血液处于层流状态时,YAP/TAZ 信号通路和血管炎症现象受到抑制,对动脉粥样硬化有保护效应[5]。高血压常伴有血液湍流的增多和血流动力学应激反应[6]。然而,有关YAP/TAZ 信号通路与高血压之间的作用机制目前罕有文献能够阐明。在Hippo 途径中,MST1/2(mammalian Sterile 20-like kinases 1/2)和LATS1/2(large tumor suppressor 1/2)发生磷酸化级联反应引起YAP/TAZ磷酸化,阻止YAP/TAZ 入核从而抑制YAP/TAZ 活性,当Hippo 通路受到抑制时,YAP/TAZ 磷酸化过程也受到抑制,非磷酸化YAP/TAZ 可进入细胞核并与TEAD 结合,调控炎症基因的转录[7]。新近的研究提示[8],Hippo通路参与心血管系统的生理病理调节,但其关键因子PDZ-binding motif(TAZ)在高血压发病机制中的作用尚无文献报道。前期的研究发现,Ang Ⅱ诱导的高血压鼠存在TAZ 蛋白激活,TAZ 蛋白可能通过介导血管的炎症引起血管损伤和高血压,但具体机制还未明确[9]。研究发现[10],蛋白磷酸酶2A(protein phosphatase 2A,PP2A)可通过磷酸化蛋白质丝氨酸及苏氨酸残基进而调控参与心血管疾病,因此,2020 年3 月—2021 年4 月,本研究通过加入PP2A 抑制剂LB-100 以及TAZ 抑制剂Ve,观察Ang Ⅱ诱导的HUVEC 细胞TAZ 的改变及MCP-1 的表达,旨在明确AngⅡ影响内皮细胞炎症因子分泌的潜在机制。
1.1 仪器与材料
SDS 电泳仪(美国Bio-Rad),化学发光成像系统(环亚生物公司),正置荧光显微镜(Olympus),Western blot 一抗:TAZ(#4883)、p-TAZ(#59971)、PP2A(#2038s)(购置于Cell Signaling),HDAC1(sc-81598),MCP-1(sc-52701),p-PP2A(sc-271903)(购 置 于Santa Cruse);
Western blot 二抗:抗鼠、抗兔(购置于Proteintech)免疫荧光二抗(A0428,购置于上海碧云天生物技术有限公司)。
1.2 方法
1.2.1 细胞培养
细胞购自武汉大学国家典型培养物保藏中心。取人脐静脉内皮HUVEC 细胞,密度为2×105个/孔,接种于6 孔培养板中。
1.2.1.1 培养方案一
培养24 h 后加入维替泊芬(verteporfin,Ve)0.5 μM 预处理细胞1 h 后,再加入Ang Ⅱ(0.1 μM)。(1)Ctr 对照组:培养液;
(2)Ang Ⅱ组;
(3)Ang Ⅱ+Ve 组;
(4)Ve 组(0.5 μM),培养24 h 后进行后续实验。
1.2.1.2 培养方案二
加入PP2A 抑制剂LB-100(0.1μM)预处理细胞1 h 后,再加入Ang Ⅱ(0.1 μM)。(1)Ctr 对照组:培养液;
(2)Ang Ⅱ组;
(3)Ang Ⅱ+LB-100 组;
(4)LB-100 组。培养24 h 后进行后续实验。
1.2.2 免疫荧光
将盖玻片置于6 孔板中,接种人脐静脉内皮HUVEC细胞,密度为2×105个/孔,培养24 h 后,依照前述的处理方法对细胞进行分组处理。弃去6 孔板培养液,PBS 洗涤5 min,清洗3 次。4%多聚甲醛室温固定15 min,PBS 洗5 min,清洗3 次。0.5% Triton 打孔,5%BSA室温封闭30 min。1:200 稀释的TAZ 一抗4℃过夜。PBS洗5 min,清洗3 次,室温避光染色FITC 标记的二抗60 min,PBS 洗5 min,清洗3 次,室温染DAPI 7 min,PBS 洗5 min,清洗3 次,甘油封片,荧光显微镜观察拍照。
1.2.3 Western blot
收集细胞,依据细胞核蛋白抽提试剂盒(BestBio,310001)说明书操作,提取分离细胞核蛋白和浆蛋白。每20 μL 细胞沉淀加入200 μL 添加了PMSF 的细胞浆蛋白抽提试剂A。冰浴10~15 min。加入细胞浆蛋白抽提试剂B 10 μL。冰浴1 min。4℃ 12 000~16 000 g 离心5 min。吸取上清即为浆蛋白。对于沉淀加入50 μL添加了PMSF 的细胞核蛋白抽提试剂。冰浴30 min。4℃12 000~16 000 g 离心10 min。上清即为细胞核蛋白。Bio-Rad 蛋白定量。使用SDS-PAGE 进行分离蛋白质,分离的蛋白质转移至微孔固相转移膜。使用5%牛血清白蛋白室温封闭2 h 后,一抗4℃孵育过夜,再使用与HRP结合的二抗室温孵育2 h。ECL化学发光法显影成像,蛋白表达将用内参进行矫正定量。
1.2.4 统计学方法
使用Image J 软件进行图像分析,GraphPad Prism 8软件进行数据统计分析及作图。计量资料用()表示,多组间比较采用单因素方差分析,P<0.05 表示差异有统计学意义。
2.1 Ve 对Ang Ⅱ引起的HUVEC 细胞核TAZ 的上调表达的影响
使用免疫荧光法检测发现,在HUVEC 细胞中,Ctr组TAZ 蛋白相对荧光量为(1.00±0.00),Ang Ⅱ组为(2.29±0.40),Ang Ⅱ+Ve 组为(0.88±0.13),Ve 组为(0.83±0.01)。Ang Ⅱ诱导HUVEC 细胞核内绿色荧光标记的TAZ 蛋白显著增加(图1)。给予TAZ 抑制剂维替泊芬显著逆转Ang Ⅱ上调的TAZ 荧光表达,Ve 组与AngII+Ve 组之间差异无统计学意义(P>0.05)。

图1 各组人脐静脉内皮HUVEC 细胞核内TAZ 的表达水平
2.2 Ve 对Ang Ⅱ引起的HUVEC 细胞炎症因子MCP-1的上调表达的影响
实验结果显示,在HUVEC 细胞中,Ctr 组MCP-1蛋白相对表达量为(1.00±0.00),Ang Ⅱ组为(1.57±0.13),Ang Ⅱ+Ve 组 为(1.08±0.11),Ve 组 为(0.82±0.10)。给予Ang Ⅱ,可明显上调MCP-1 的表达(P<0.05)。给予TAZ 抑制剂Ve 后,与Ang Ⅱ对比,可明显降低Ang Ⅱ引起的血管内皮细胞MCP-1 的上调表达(P<0.05),Ve 组与Ang Ⅱ+Ve 组之间差异无统计学意义(P>0.05)。见表1。
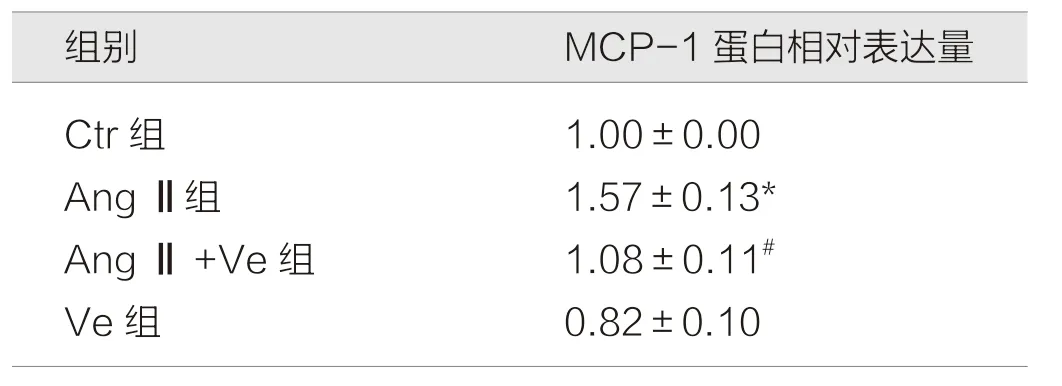
表1 各组人脐静脉内皮HUVEC 细胞核内MCP-1 的表达水平
2.3 Ang Ⅱ对PP2A 蛋白磷酸化促进TAZ 入核引起HUVEC 细胞MCP-1 的表达水平的影响
结果表明,Ang Ⅱ可明显下调p-PP2A 的表达(P<0.05)。使用PP2A 抑制剂LB-100,与Ang Ⅱ组比较,可明显上调胞浆p-TAZ 的表达水平(P<0.05),明显降低核内TAZ 的蛋白水平(P<0.05)。LB-100 可明显降低HUVEC 细胞中MCP-1 表达(P<0.05),LB-100 组与Ang Ⅱ+LB-100 组之间差异无统计学意义(P>0.05)见表2。
血管内皮细胞已被证明[11],具多种自分泌及旁分泌功能,是体内最大的内分泌器官。可以通过产生和释放各种活性物质调节血管的功能,其中炎性趋化因子MCP-1是调控募集单核巨噬细胞黏附到内皮细胞表面的重要炎症因子[12-13]。巨噬细胞在病理条件下,可以释放一些细胞因子如tumor necrosis factor(TNFα)、interleukin-1(IL-1)等,由此引起血管内皮炎症反应,如高血压血管损伤常伴有血管炎性细胞因子表达增加[14-15]。最新研究表明[16],在MCP-1基因转录起始位点存在TEAD 模块,TAZ 入核与TEAD 结合可启动MCP-1 蛋白表达。肝细胞中双敲除TAZ 上游抑制因子Mst1 和Mst2 基因可以导致MCP-1 的表达上调,M1 和M2 混合表型巨噬细胞大量浸润[16]。实验结果显示,Ang Ⅱ可通过上调TAZ 的表达,诱导上调MCP-1 的表达。这提示Ang Ⅱ可能通过激活血管内皮细胞TAZ 引起MCP-1 表达,进而募集巨噬细胞浸润血管引起血管炎症。
肾素-血管紧张素系统(renin-angiotensin system,RAS)在高血压的调节和控制过程中发挥着重要的作用[17],大量的临床实验研究表明血管紧张素转换酶抑制剂和血管紧张素I 型受体阻断剂(angiotension receptor blocker,ARB)不但能有效地降低血压,而且能够减轻高血压引起的心,脑,肾,血管等并发症[18]。肾素血管紧张素在血浆和组织脏器中的表达量有所不同,依据其表达量的多少还可分为肾素依赖型和非依赖型高血压[19]。血管紧张素Ⅱ(Ang Ⅱ)是RAS 中生物活性最高的成分,Ang Ⅱ通过与血管紧张素Ⅱ 1 型受体(angiotensin Ⅱtype 1receptor,AT1R)结合可促进血管收缩、血管平滑肌细胞增殖以及炎症因子分泌[17,20]。Ang Ⅱ还可通过增加活性氧自由基(reactive oxygen species,ROS)的释放降低血管内皮NO 生物活性,损害血管内皮细胞,减弱血管舒张功能[21]。在笔者前期的研究结果中发现[9],连续两周给予小鼠灌注Ang Ⅱ可诱导其产生稳定的高血压及主动脉TAZ 蛋白激活,TAZ 蛋白可能通过介导血管炎症引起血管损伤和高血压。
核外TAZ 蛋白是失活状态,TAZ 蛋白丝氨酸89 位点被磷酸化修饰后会停留在细胞浆中并最终被降解,此时细胞增殖抑制,走向凋亡或分化。而当细胞受到一些TAZ 激活因子的刺激时,比如不规则的血流冲击下,TAZ蛋白入核,与下游TEAD 因子结合,发挥转录调节作用,促进细胞增殖[22]。因此,考察其激活与失活主要检测入核后的原型(TAZ)和胞浆中的磷酸化形式(p-TAZ)。结果显示,Ang Ⅱ可以明显上调HUVEC 细胞核内TAZ 蛋白表达(P<0.05),因此推测TAZ 上游可能存在某种调节它的蛋白磷酸酶。蛋白磷酸酶2A(protein phosphatase 2A,PP2A)对蛋白质丝氨酸及苏氨酸残基的去磷酸化作用进而调控多种细胞进程包括细胞增殖、分化、迁移等。尤其是它广泛参与心血管疾病的调节[23]。研究发现[24],PP2A 亚基酪氨酸307 位点磷酸化增加,可导致PP2A 活性降低。在Ang Ⅱ诱导的高血压大鼠肠系膜动脉中,Ang Ⅱ通过降低PP2A Tyr307 磷酸化水平激活PP2A,进而降低eNOS S1177 磷酸化导致血管内皮功能障碍[25]。在我们实验中,我们推测PP2A 有可能通过去磷酸化TAZ蛋白促进其激活。结果显示,Ang Ⅱ可明显降低p-PP2A的表达(P<0.05),激活PP2A。使用PP2A 抑制剂LB-100 可上调胞浆p-TAZ 水平,降低核内TAZ 蛋白水平(表2)。这提示Ang Ⅱ可能通过激活PP2A 引起TAZ 通路的活化(去磷酸化)。未来我们将进一步使用PP2A-siRNA考察TAZ 和p-TAZ 蛋白表达以及核内外分布情况。

表2 Ang Ⅱ对PP2A-TAZ 通路各因子表达水平的影响
结果表明,PP2A/TAZ 通路参与了Ang Ⅱ诱导的HUVEC 细胞MCP-1 蛋白表达。PP2A 抑制剂LB-100 治疗抑制了HUVEC 细胞中TAZ 的激活以及MCP-1 炎症因子的表达。笔者的研究结果表明PP2A/TAZ 通路参与了Ang Ⅱ诱导的血管内皮细胞损伤,综上所述,Ang Ⅱ可能通过上调血管内皮细胞PP2A-TAZ 通路促进炎症相关因子MCP-1 的表达。
猜你喜欢 细胞核磷酸化内皮细胞 有氧运动和精氨酸补充对高血压的干预作用及其与内皮细胞功能的关系体育科技文献通报(2022年4期)2022-10-21阿尔茨海默病脑TAU蛋白磷酸化位点综述中风与神经疾病杂志(2022年9期)2022-10-19眼库获取的角膜内皮细胞密度变化规律及影响因素研究△中国眼耳鼻喉科杂志(2022年3期)2022-05-29指向科学思维的“细胞核的结构与功能”教学设计中学生物学(2022年3期)2022-05-13人参bZIP基因家族生物信息学分析中草药(2022年9期)2022-05-06T69E模拟磷酸化修饰对Bcl-2与Nur77相互作用的影响波谱学杂志(2022年1期)2022-03-15GDM孕妇网膜脂肪组织中Chemerin的表达与IRS-1及其酪氨酸磷酸化分析昆明医科大学学报(2022年1期)2022-02-28“糖衣”告诉细胞何时造血科学大观园(2021年1期)2021-01-11“细胞核—系统的控制中心”一节的教学设计新教育时代·教师版(2018年48期)2018-01-24磷酸化肽富集新方法研究进展分析化学(2017年12期)2017-12-25猜你喜欢
- 2024-01-20 有关于第五次全国经济普查统计重点业务综合培训大会上讲话(完整文档)
- 2024-01-20 “严纪律、转作风、保安全、树形象”专题学习教育活动通知(完整文档)
- 2024-01-20 2024XX区住房城乡建设工作情况汇报
- 2024-01-20 2024高校思政教育交流材料:善用反腐败斗争这堂“大思政课”(精选文档)
- 2024-01-20 2024年主题教育专题党课辅导报告,(4)
- 2024-01-20 关于赴某地学习考察地方立法工作情况报告(范文推荐)
- 2024-01-20 2024年度关于增强党建带团建工作实效对策与建议(精选文档)
- 2024-01-20 教师演讲稿:春风化雨育桃李,,潜心耕耘满芬芳(全文)
- 2024-01-20 主题教育第二阶段来了
- 2024-01-20 2024年度关于到信访局实践锻炼个人总结【完整版】
- 搜索
-
- 打赌输了任人处理作文1000字7篇 05-12
- 当代大学生在全面建设社会主义现代化强 05-12
- 全面建成社会主义现代化强国的战略安排 03-10
- 个人廉洁自律方面存在的问题及整改措施 05-12
- 谈谈青年大学生在中国式现代化征程上的 05-12
- 2022年党支部第一议题会议记录(全文完 11-02
- 作为青年大学生如何肩负时代责任6篇 05-12
- 村党组织建设现状及工作亮点存在问题与 05-12
- 全面从严治党,自我革命重要论述研讨会 05-12
- 产业工人队伍建设改革(全文完整) 10-31
- 11-25国庆70周年庆典晚会 庆典晚会串词
- 11-25办公室礼仪的十大原则 浅谈办公室的电话礼仪
- 01-17用心灵轻轻地歌唱_心灵的歌唱
- 01-17也许你不是我一生的唯一|也许不是我
- 01-17爱了,请珍惜;不爱,趁早放手|爱就珍惜不爱就放手
- 01-17岁月带走的是记忆,但回忆会越来越清晰|有趣又有深意的句子
- 01-17曾经的美好只是曾经,我只想珍惜身边的人|我只想珍惜你
- 01-18从容不惊 [学会笑眼去看世界,不惊不乍,淡定从容]
- 02-03当代大学生学习态度调查报告
- 02-03常用护患英语会话
- 标签列表
