首页 > 心得体会 > 学习材料 / 正文
PKCι对维持KRAS突变结肠癌生存的作用及机制
2023-01-18 13:10:11 ℃朱玥 潘珏宇 王佩佩 李楠 朱彤波
(四川大学华西基础医学与法医学院免疫教研室,四川 成都 610041)
根据2019年全球癌症统计数据,结肠癌为全球第三大癌症,发病率为10.2%,死亡率为9.2%,仅次于肺癌[1]。KRAS属于RAS基因家族,其突变广泛存在于多种癌症中,结肠癌患者中约40%含有KRAS突变[2]。虽然近年来针对KRASG12C的药物筛选取得了一定的进展,但其作用效果与作用机制仍未明确[3]。故寻找与KRAS有交互作用,可选择性诱导携KRAS突变结肠癌细胞凋亡的信号蛋白仍非常重要。PKCι属于非典型性蛋白激酶C(atypical protein kinase C,aPKC),可通过磷酸化丝氨酸/苏氨酸从而激活下游多条信号通路,有研究证明aPKC的异常激活与结肠癌生成有密切关系[3-5]。
Yes相关蛋白1(Yes-associated protein 1,YAP1)是Hippo信号通路的关键信号分子。已有研究表明,YAP1在包括结肠癌在内的多种癌症中均存在异常升高的表达[6],可促进癌症细胞生长、迁移、上皮-间充质转化(EMT)并诱导干细胞特性[7-9]。本研究通过化学抑制剂或shRNA分别对结肠癌细胞中的KRAS、PKCι进行抑制,并在mRNA、蛋白、细胞水平观察YAP1等信号分子在结肠癌细胞中的变化,探讨PKCι在携KRAS突变的结肠癌细胞生长中的作用及其与Hippo信号通路的关系。
1.1 细胞及主要试剂 细胞株HCT116、RKO、293T为四川大学基础医学与法医学院免疫教研室贮存细胞。抗体:PKCι(BD Biosciences),GAPDH,YAP1(CST, Cell Signaling Technology),PDL1(Abcam)。脂质体Lipofectamine®2000、胎牛血清、凯基凋亡试剂盒购于成都溶海康华生物科技有限公司,RPMI-1640、DMEM、YQ培养基购自成都晨飞生物技术有限公司,ATM(Aurothiomalate)购自Sigma公司。逆转录及RT-PCR试剂盒购于成都微克生物技术有限公司。本研究所用引物均为上海生工有限公司合成。质粒pLL3.7-prkci、pLL3.7-kras为本课题组前期构建的重组质粒,包装质粒PSPA×2、PMD2G为课题组贮存质粒。
1.2 实验方法
1.2.1 实验分组 以携KRAS突变的HCT116和不携KRAS突变的RKO结肠癌细胞为研究对象,用慢病毒shRNA-prkci和PKCι活性抑制剂(ATM)分别处理上述两种细胞,即慢病毒shRNA-prkci组、ATM组,分别与Control组和shRNA-Control比较并检测相应指标并观察其变化。
1.2.2 慢病毒的制备 使用YQ培养基,以5×106/mL的密度将293T细胞接种于100 mm2培养皿中。细胞培养12 h,将含有shRNA序列的重组质粒以及包装质粒使用脂质体Lipofectamine®2000转入293 T细胞。48 h后收取上清液,4℃、3000 r/min,离心15 min;
0.45 μm PVDF过滤器过滤,EP管分装(1 mL/管)置于-80℃备用。shRNA序列信息:shRNA-prkci: 5′-GGTTGTTCCTGGTCATTGAGTA-3′,shRNA-kras:5′-GCAGTTGAGACCTTCTAATTGG-3′。
1.2.3 细胞处理 以3×105/mL的密度接种细胞于六孔板。用ddH2O 配制ATM浓度为1 M,使用终浓度为0.1 mM ATM分别处理细胞36 h和48 h后,进行实时荧光定量PCR(qRT-PCR)和WB 实验。同时用制备的慢病毒液感染HCT116和RKO细胞10 h后换液,收样前观察荧光强度为70%以上,表明感染成功。最后根据不同的实验目的在相应的时间段内处理收样。
1.2.4 免疫印迹法(Western blot) 使用RIPA裂解液提取细胞总蛋白,使用碧云天BSA试剂盒定量后,加入Loading buffer,金属浴100℃煮样10 min,使蛋白变性。电泳条件为80 V 30 min后调节电压为120 V,继续1 h。转膜条件为300 mA 1.5 h,使用0.22 μm孔径PVDF膜。5%脱脂牛奶室温封闭1 h。一抗封闭4℃过夜,二抗室温孵育1 h,使用TBST洗涤三次(5 min/次)后曝光检测。
1.2.5 qRT-PCR检测 采用Trizol法(Invitrogen)提取细胞总RNA,使用RT reagentKit with Gdna Eraser试剂盒逆转录获得cDNA。使用TB green Premix Ex Taq试剂盒于实时荧光PCR仪上检测靶基因的相对表达量,引物序列见表1。

表1 qPCR引物序列
1.2.6 Annexin V-FITC/PI 标记凋亡细胞 使用不含EDTA胰酶将细胞消化后,PBS洗3次(PBS需提前预冷),每管的染料配方为500 μL 1×buffer+5 μL Annexin V-FITC/PI,使用染料混合液重悬细胞后,冰上避光孵育15 min;
上机检测。
1.2.7 免疫荧光技术及共聚焦显微镜成像分析 将处理后的细胞移除培养基,4%多聚甲醛固定15 min,去除固定液后0.3% Tritonx-100通透10 min,5%BSA封闭1 h,封闭完成后依次孵育一抗2 h、二抗1 h,移除二抗后以1 μg/mL DAPI溶液染核5 min,移除DAPI溶液后封片,共聚焦显微镜观察拍照。
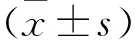
2.1 PKCι的抑制可诱导KRAS突变结肠癌细胞凋亡 与对照组凋亡率3%相比,PKCι抑制剂ATM处理可使HCT116凋亡率升高至16%左右,同样,在使用shRNA抑制PKCι表达后,HCT116凋亡率由6%升高至10%,差异有统计学意义(P<0.05),而对于不携KRAS突变的RKO细胞,对照组、ATM处理组与shRNA对照组、处理组凋亡率分别为6%、7%、8%、9%左右,差异无统计学意义(P>0.05)。见图1。

图1 流式细胞仪检测抑制PKCι对KRAS突变结肠癌细胞生长的影响
2.2 PKCι可影响KRAS突变结肠癌细胞的YAP1表达水平 Western blot(图2A)与免疫荧光(图2B)实验均证明,在HCT116细胞中,ATM抑制PKCι活性,可显著下调YAP1的表达(P<0.05) ;
而在不携带KRAS突变的RKO细胞中这些抑制作用则不明显,提示在KRAS突变的结肠癌细胞中,YAP1的表达水平及活性可能受PKCι调控。

图2 抑制PKCι对KRAS突变结肠癌细胞YAP1表达的影响
2.3 PKCι-YAP1信号轴受KRAS调控 在携KRAS突变的HCT116细胞中使用shRNA抑制PKCι表达后,可显著抑制YAP1表达水平(P<0.05);
且KRAS表达被敲低后,PKCι与YAP1的表达均明显下调(图3)。提示在KRAS突变结肠癌细胞中,PKCι可影响YAP1的表达,且PKCι与YAP1均受到KRAS的调控。突变的KRAS通过激活PKCι-YAP1信号以维持结肠癌细胞生长。
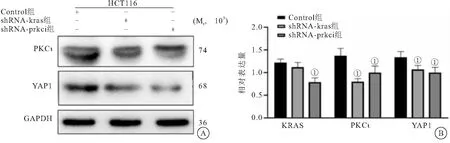
图3 PKCι-YAP1信号轴受KRAS调控
结肠癌是世界上发病率最高,致死率最高的癌症之一,携KRAS突变的结肠癌患者占结肠癌患者的40%[2-3],KRAS作为致瘤子基因与多种肿瘤的发生发展[4-6],调节细胞糖酵解过程[7]以及对表皮生长因子受体(EGFR) 抑制剂耐药性有显著相关性[10],导致KRAS突变患者预后不良比例较高,常被作为预后不良的标志[11]。目前针对KRAS突变的药物筛选有了长足的进步,针对KRASG12C的抑制剂已经进入临床实验阶段[12-13],但是其作用效果与安全性还有待进一步阐明,针对KRAS突变肿瘤下游信号通路中与KRAS有交互作用信号蛋白的研究仍有重要意义。
蛋白激酶C(PKC) 是一个结构相关的丝氨酸/苏氨酸蛋白激酶家族,在细胞增殖迁移以及维持细胞功能中起到重要的作用[14-15]。其中PKCι属于非典型性PKC(aPKC) 家族的一员,在结肠癌中有显著上调,在促进肿瘤的形成与发展过程中起着重要的作用[16-17]。PKCι的表达水平与KRAS突变在肺腺癌(LAC)与胰腺导管癌(PDCA) 中有显著的相关性[18-20]。在本研究中,发现KRAS突变的结肠癌细胞中PKCι表达水平明显上升,在使用ATM或shRNA抑制PKCι的表达后,可特异性的诱导携KRAS突变的结肠癌细胞凋亡,证明KRAS突变与PKCι表达相关性在结肠癌中同样存在。
YAP1是Hippo信号通路中的一个重要分子,可上调与细胞增殖、重编程、干细胞特性、上皮-间充质转化、以及抗凋亡相关的转录因子[21-24],在肿瘤的发生与维持过程中起到重要的作用。YAP1可通过诱导ERK通路激活,通过调控AXL使癌细胞对于EGFR-TKI产生耐药,这与KRAS突变导致的EGFR耐药有着高度相似性,提示YAP1与KRAS突变之间存在某种联系[25]。本研究的前期研究中发现在PDCA中KRAS突变可导致PKCι的表达水平的异常升高,PKCι的异常升高可抑制LATS导致YAP1的去磷酸化在细胞核中积累,从而起到激活多种转录因子促进肿瘤细胞生长的作用[26]。本研究显示,在KRAS突变结肠癌抑制PKCι同样可导致YAP1的明显下调以及细胞凋亡,提示KRAS突变条件下,PKCι对YAP1的调控在结肠癌中同样存在。
本研究证明了在结肠癌细胞中PKCι为Hippo信号通路的调控因子,并影响YAP1分子的表达以及在其促进肿瘤细胞增殖的相关目标基因转录。同时PKCι与YAP1的表达增加以及PKCι对YAP1的调控依赖于KRAS在结肠癌中的突变。
本研究选用携KRAS突变HCT116和不携KRAS突变的RKO结肠癌细胞株作为肿瘤细胞模型,通过shRNA敲低和使用活性抑制剂两种处理方式从mRNA水平和蛋白表达水平等层面对KRAS、PKCι和YAP1之间调控关系的研究,最终发现PKCι、YAP1为KRAS突变结肠癌的潜在治疗靶点,为KRAS突变结肠癌的药物开发与治疗提供了新的思路。
猜你喜欢 质粒结肠癌试剂盒 左、右半结肠癌基因表达差异的研究医学信息(2022年4期)2022-11-26——一道江苏高考题的奥秘解读和拓展">农杆菌转化法中的“Ti质粒转化载体系统”的简介——一道江苏高考题的奥秘解读和拓展中学生物学(2022年7期)2022-09-07全基因组测序后质粒的组装与鉴定研究进展*成都医学院学报(2022年4期)2022-08-19病原菌多重核酸检测试剂盒分析性能质量评价研究传染病信息(2022年3期)2022-07-15玻璃珠-涡旋振荡改良法用于硅藻DNA 提取法医学杂志(2022年1期)2022-06-21开发新方法追踪植物病害的全球传播(2020.6.7 iPlants)三农资讯半月报(2020年11期)2020-06-21为什么确诊新冠肺炎需要核酸检测试剂盒?保健与生活(2020年6期)2020-03-20小鼠转录因子STATl真核表达质粒的构建及生物学功能分析江苏农业学报(2019年1期)2019-09-1018F—FDG配套试剂盒的开发中国卫生产业(2018年12期)2018-05-14助“癌”为虐的细菌大自然探索(2017年12期)2018-03-02
猜你喜欢
- 2024-01-20 有关于第五次全国经济普查统计重点业务综合培训大会上讲话(完整文档)
- 2024-01-20 “严纪律、转作风、保安全、树形象”专题学习教育活动通知(完整文档)
- 2024-01-20 2024XX区住房城乡建设工作情况汇报
- 2024-01-20 2024高校思政教育交流材料:善用反腐败斗争这堂“大思政课”(精选文档)
- 2024-01-20 2024年主题教育专题党课辅导报告,(4)
- 2024-01-20 关于赴某地学习考察地方立法工作情况报告(范文推荐)
- 2024-01-20 2024年度关于增强党建带团建工作实效对策与建议(精选文档)
- 2024-01-20 教师演讲稿:春风化雨育桃李,,潜心耕耘满芬芳(全文)
- 2024-01-20 主题教育第二阶段来了
- 2024-01-20 2024年度关于到信访局实践锻炼个人总结【完整版】
- 搜索
-
- 打赌输了任人处理作文1000字7篇 05-12
- 当代大学生在全面建设社会主义现代化强 05-12
- 全面建成社会主义现代化强国的战略安排 03-10
- 个人廉洁自律方面存在的问题及整改措施 05-12
- 谈谈青年大学生在中国式现代化征程上的 05-12
- 2022年党支部第一议题会议记录(全文完 11-02
- 作为青年大学生如何肩负时代责任6篇 05-12
- 村党组织建设现状及工作亮点存在问题与 05-12
- 全面从严治党,自我革命重要论述研讨会 05-12
- 产业工人队伍建设改革(全文完整) 10-31
- 11-25国庆70周年庆典晚会 庆典晚会串词
- 11-25办公室礼仪的十大原则 浅谈办公室的电话礼仪
- 01-17用心灵轻轻地歌唱_心灵的歌唱
- 01-17也许你不是我一生的唯一|也许不是我
- 01-17爱了,请珍惜;不爱,趁早放手|爱就珍惜不爱就放手
- 01-17岁月带走的是记忆,但回忆会越来越清晰|有趣又有深意的句子
- 01-17曾经的美好只是曾经,我只想珍惜身边的人|我只想珍惜你
- 01-18从容不惊 [学会笑眼去看世界,不惊不乍,淡定从容]
- 02-03当代大学生学习态度调查报告
- 02-03常用护患英语会话
- 标签列表
