首页 > 心得体会 > 学习材料 / 正文
功能化Janus微球用于Hg2+可视化检测
2023-03-17 17:40:13 ℃王栋,王磊,邢洋,张羱,双少敏*
(1.山西大学 化学化工学院,山西 太原 030006;
2.山西医科大学 药学院,山西 太原 030006)
汞离子(Hg2+)作为常见的高毒性重金属离子,可稳定存在于环境中[1-2]。人体摄入过量的Hg2+会破坏其正常的新陈代谢和中枢神经系统,引起肠胃溃疡、神经错乱、呼吸衰竭等,最终导致死亡[3-5]。因此,对环境中的Hg2+进行有效的监测具有重要意义。目前,常用于Hg2+检测的方法包括电感耦合等离子质谱[6-8]、高效液相色谱[9-10]、原子光谱法[11-13]等。而这些方法通常需要昂贵的仪器和复杂的样品前处理过程,限制了其广泛应用[14]。因此,迫切需要发展简便、易行的Hg2+可视化测定方法。
Janus微球是一类具有两个或多个表面区域的微球,这些表面区域表现出不同的理化性质,并以不对称的方式分布于单个粒子表面[15]。由于Janus微球在形状[16]、组成[17]、表面化学[18]等方面表现出各向异性,因此,它能够在单个粒子内提供截然不同的化学或物理性质。近年来,基于各种方法制备的Janus微球,在传感和成像应用方面取得了令人瞩目的进展[19-21]。Kang等[22]将聚丁二炔(PDA)和高效吸附剂海藻酸盐集成在磁性Janus微珠中,同时实现对铅(II)离子的灵敏检测。受其启发,我们尝试开发一种基于海藻酸钠的Janus微球,用于Hg2+的可视化检测。
本文将Ag NPs和Fe3O4NPs的海藻酸钠水溶胶通过微流体法制备得到Janus微球。对于Ag NPs,将Hg2+还原为Hg并沉积在其表面,导致了银汞齐的产生,进而改变了其表面等离子体共振效应,实现Hg2+的可视化及定量检测。另一侧具有Fe3O4NPs,通过施加磁场可以搅动溶液中的微球,有助于短时间内与更多目标离子反应,从而提高灵敏度,减少检测时间。此外,利用磁场对磁性微球进行选择性收集,可方便地清洗未结合或非特异结合的离子,并可进行微球的回收,展现出便捷的Hg2+检测。
1.1 试剂与仪器
氯化汞(HgCl2)、二水合柠檬酸三钠(C6H5Na3O7·2H2O)、硼氢化钠(NaBH4)、碘化钾(KI)、碳酸氢钠(NaHCO3)、硝酸银(AgNO3)、三氯化铁(III)六水合物(FeCl3·6H2O)、氯化亚铁,四水(FeCl2·4H2O)、海藻酸钠(C6H7O8Na)n、氯化钙,二水(CaCl2·2H2O)购于阿拉丁试剂公司。所用试剂均为分析纯,实验用水为二次蒸馏水(18.2 MΩ·cm,Milli-Q纯水仪(美国Millipore公司)制备)。
Nano ZS90动态光散射粒度分析仪(英国马尔文公司)、JEM-2100型透射电子显微镜(日本电子公司)、U-2910紫外可见分光光度计(日本日立公司)、H2-16K-II离心机(湖南可成仪器设备有限公司)、电子天平(FA2004B)、FE20酸度计(上海梅特勒-托利多仪器有限公司)、真空干燥箱(上海一恒科学仪器有限公司)。
1.2 Ag NPs制备
室温下,量取30 mL 2.0 mmol/L的NaBH4溶液于圆底烧瓶中,加入4.0 mL 2.5 mmol/L的C6H5Na3O7·2H2O溶液,在磁力搅拌(500 r/min)和室温下混合均匀后,缓慢滴加10 mL 1.25 mmol/L的AgNO3溶液,500 r/min的转速下搅拌30 min,溶液颜色由无色变为深黄色,离心,蒸馏水洗涤,50℃真空干燥得到Ag NPs。
1.3 Fe3O4NPs的制备
称取4 g FeCl3·6H2O和3 g FeCl2·4H2O依次加入250 mL二次水中,置于500 mL容量瓶中,在N2保护下加热到80℃~85℃,再逐滴加入浓氨水将反应液的pH调至9左右,持续搅拌(600 r/min)1 h后,冷却至室温,磁分离得到固体产物用二次水和乙醇洗涤至中性,50℃真空干燥得黑褐色固体Fe3O4NPs[23]。
1.4 Janus海藻酸钠微球的制备
为了防止Fe3O4NPs与藻酸盐的羧基相互作用,称取0.2 g Fe3O4NPs,超声分散于10 mL二次水中,加入0.2 g C6H5Na3O7·2H2O,于95℃反应2 h,冷却至室温,加入丙酮沉淀分离Fe3O4NPs。
将改性后的Fe3O4NPs(10 mg)和Ag NPs(20 mg)分别分散于10 mL质量百分数为4.0%的海藻酸钠水溶胶中。上述水溶胶分别放置于两个注射器中,逐滴滴入100 mL CaCl2(质量百分数4.0%)溶液中,固化后得到基于海藻酸钠的Janus微球。
2.1 Ag NPs和Fe3O4NPs的表征
如图1(a)所示,由TEM图像可以看出,Fe3O4NPs形貌呈球状,粒径分布均匀,约为30 nm。通过粒度仪测得Ag NPs和Fe3O4NPs的平均粒径分别为17 nm和36 nm(图1(b))。

图1 (a)Fe3O4NPs的透射电镜图;
(b)Ag和Fe3O4NPs的粒径图Fig.1 (a)TEM images of Fe3O4NPs;(b)Particle size ofAg and Fe3O4NPs
2.2 Janus微球的表征
利用微流控原理设计了简单的装置,并制备了基于海藻酸钠的Janus微球。该Janus微球一侧为黑色的Fe3O4NPs,另一侧为黄色的Ag NPs,且固化后两相互不相容(图2(a))。由于磁性Fe3O4NPs的存在,该Janus微球在水溶液中可以通过外加磁场进行分离回收。如图2(b)所示,Janus微球一侧的Fe3O4NPs被外加磁场吸附至瓶壁,说明其具有良好的磁分离效果。

图2 (a)制备好的Janus微球;
(b)Janus微球的分离回收Fig.2 (a)Prepared Janus microsphere;(b)Separation and recovery of Janus microspheres
2.3 Janus微球检测Hg2+的影响因素考察
2.3.1 pH对Hg2+检测的影响
实际水样中Hg2+检测的重要影响因素之一样品中H+的浓度。如图3所示,无论是否存在Hg2+,该Janus微球均在pH为2具有最大吸收,在pH为4时具有最小吸收。但在pH=6时两者差距最大,由于柠檬酸会在Ag NPs表面质子化,进一步导致了Janus微球酸性不稳定。因此,结合实验结果说明在pH=6时,该Janus微球灵敏度最高。
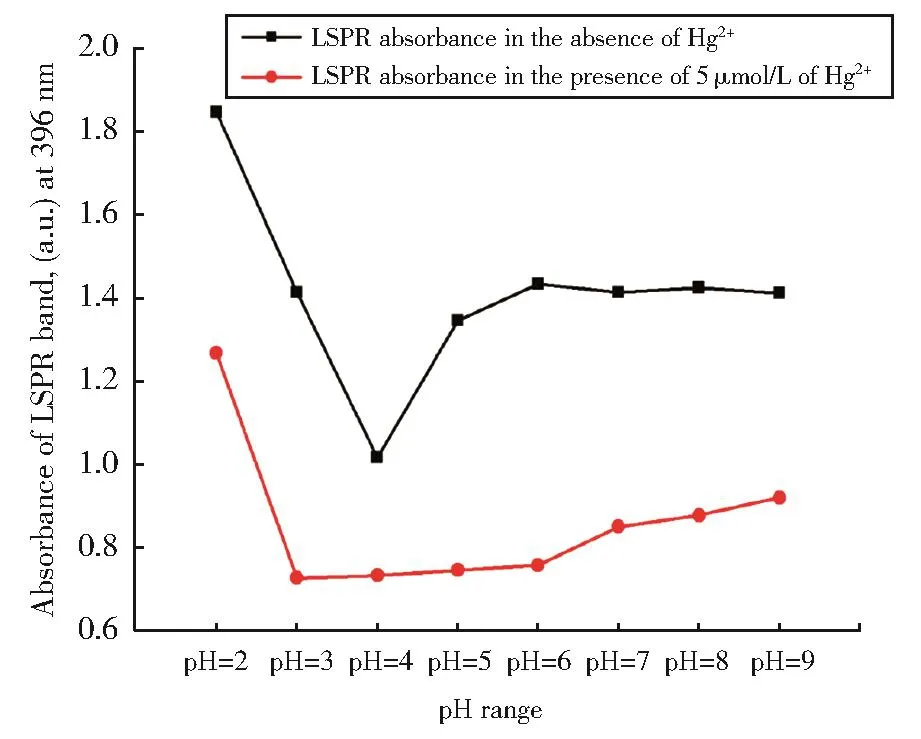
图3 pH对Janus微球检测汞离子的影响Fig.3 The effect of pH on the detection of Hg2+by Janus microsphere
2.3.2 响应时间对Hg2+检测的影响
考察了Hg2+与Janus微球的响应时间。在Janus微球中加入Hg2+后,测定不同反应时间395 nm处的吸光度,以确定Hg2+与Janus微球的最佳响应时间。如图4所示,7 min后395 nm处的吸光度基本不变,因此,将最佳响应时间确定为7 min。

图4 Janus微球对汞离子响应时间(Janus微球(1 g),2 mL Hg2+(5 μmol/L))Fig.4 Response time of Janus microspheres to Hg2+(Janus microspheres(1 g),2 mL Hg2+(5 μmol/L))
2.3.3 共存离子对Hg2+检测的影响
为了考察Janus微球对Hg2+的选择性,在Janus微球中加入Na+、K+、Ca2+、Cu2+、Mn2+、Mg2+、Fe2+、Ni2+和Pb2+。结果如图5所示,只有加入Hg2+才能引起Janus微球在395 nm紫外吸收的改变,而其他金属离子对紫外吸收变化影响微弱,表明Janus微球在共存离子存在下可选择性识别检测Hg2+。

图5 不同金属离子对Janus微球紫外光谱影响的柱状图Fig.5 Columns plot of Janus microspheres in the presence of different metal ions
2.4 Janus微球检测Hg2+
从紫外吸收光谱可见,在395 nm处随着Hg2+浓度的增加,吸光度值不断下降(图6(a))。如图6(b)所示,以浓度对吸光度比值作图,线性回归方程为
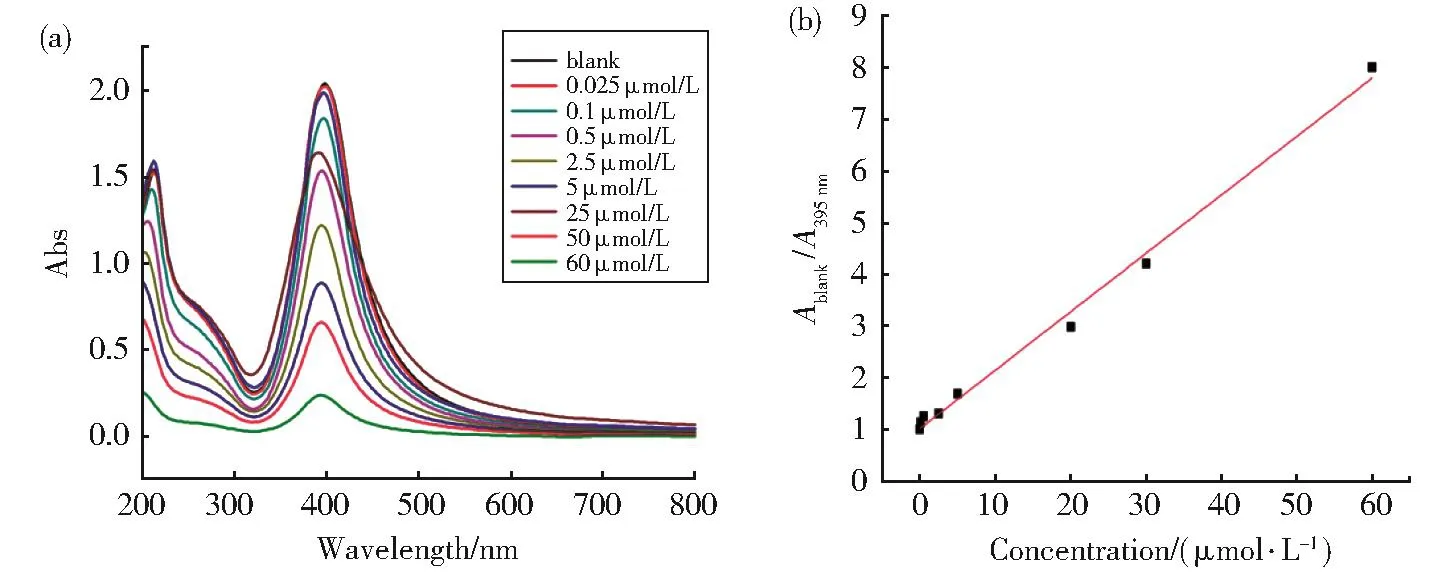
图6 (a)Hg2+(0.025 μmol/L~60 μmol/L)浓度对Janus微球(1 g)紫外吸收的影响;
(b)Janus微球与Hg2+之间的z线性拟合Fig.6 (a)Influence of Hg2+(0.025µmol/L-60µmol/L)concentration on the ultraviolet absorption of Janus microspheres(1 g);(b)Linear fit between Janus microsphere and Hg2+

该检测方法在0.025 μmol/L~ 60 μmol/L表现出良好的线性关系,且检测限为3.8 nmol/L,低于国家饮用水的标准(10 nmol/L),进一步说明了该Janus微球用于饮用水中Hg2+检测的可行性。
2.5 实际样品中Hg2+的检测
量取实验室自来水,令德湖水和迎泽公园湖水静置12 h后,0.22 μm滤膜过滤得到处理好的水样。通过加标回收实验,用Janus微球检测水样中的Hg2+,结果见表1,回收率在95.2%~104.3%,表明该Janus微球可以用于实际水样的检测。

表1 水样中Hg2+的检测结果Table 1 Determination results of Hg2+in water sample
2.6 Janus微球测定Hg2+机理
如图7所示,该装置是基于微流控原理设计而成,将Fe3O4NPs和Ag NPs分别分散在海藻酸钠水溶胶中,加入左右两个注射器中。同时按压注射器,两种溶液混合后滴入CaCl2溶液中,海藻酸钠与钙离子之间迅速发生离子交换,固化形成凝胶,制备得到两相各异的Janus微球。在该Janus微球中,黑色相(Fe3O4NPs)与黄色相(Ag NPs)相互独立,各占据球体的一半,在水溶液表现出良好的稳定性。将制备好的Janus微球置于Hg2+溶液中,黄色相中,Ag NPs将Hg2+还原为Hg并沉积在其表面,导致了银汞齐的产生,进一步导致其表面等离子体信号的变化,从而实现对Hg2+的可视化检测。在磁铁作用下,黑色相(Fe3O4NPs)均向磁铁方向聚集,实现了微球的快速分离。

图7 制备Janus微球示意图Fig.7 Schematic diagram of preparing Janus microsphere
本文基于微流控法合成了具有两个独立相的基于海藻酸钠的Janus微球。该Janus微球的Ag NPs和Fe3O4NPs的协同可实现快速,准确的可视化检测Hg2+,检测范围为0.025 μmol/L~60 μmol/L,检测限为3.8 nmol/L。本方法对Hg2+的检测灵敏度高、选择性好,将其应用于自来水中Hg2+的检测,结果令人满意。综上可知,本研究建立的Janus微球对Hg2+具有良好的检测性能和实际应用价值。
猜你喜欢 微球海藻水样 海藻球作文周刊·小学四年级版(2022年8期)2022-03-11悬浮聚合法制备窄尺寸分布聚甲基丙烯酸甲酯高分子微球潍坊学院学报(2020年6期)2020-11-22HC油田N138区注入水配伍性研究长江大学学报(自科版)(2019年10期)2019-11-04海藻与岩石之间小学生必读(低年级版)(2019年5期)2019-08-30我国相关标准水样总α、总β放射性分析方法应用中存在的问题及应对辐射防护通讯(2019年3期)2019-04-26平行水样分配器在环境监测中的应用绿色科技(2018年24期)2019-01-19水样童年意林(儿童绘本)(2018年10期)2018-11-08欧盟:海藻酸、海藻酸盐作为食品添加剂无安全风险食品与生活(2017年12期)2018-01-09葛根素生物黏附微球的制备及评价中成药(2017年6期)2017-06-13可吸收止血微球在肝脏部分切除术中的应用中国当代医药(2015年29期)2015-03-01猜你喜欢
- 2024-01-20 有关于第五次全国经济普查统计重点业务综合培训大会上讲话(完整文档)
- 2024-01-20 “严纪律、转作风、保安全、树形象”专题学习教育活动通知(完整文档)
- 2024-01-20 2024XX区住房城乡建设工作情况汇报
- 2024-01-20 2024高校思政教育交流材料:善用反腐败斗争这堂“大思政课”(精选文档)
- 2024-01-20 2024年主题教育专题党课辅导报告,(4)
- 2024-01-20 关于赴某地学习考察地方立法工作情况报告(范文推荐)
- 2024-01-20 2024年度关于增强党建带团建工作实效对策与建议(精选文档)
- 2024-01-20 教师演讲稿:春风化雨育桃李,,潜心耕耘满芬芳(全文)
- 2024-01-20 主题教育第二阶段来了
- 2024-01-20 2024年度关于到信访局实践锻炼个人总结【完整版】
- 搜索
-
- 打赌输了任人处理作文1000字7篇 05-12
- 当代大学生在全面建设社会主义现代化强 05-12
- 全面建成社会主义现代化强国的战略安排 03-10
- 个人廉洁自律方面存在的问题及整改措施 05-12
- 谈谈青年大学生在中国式现代化征程上的 05-12
- 2022年党支部第一议题会议记录(全文完 11-02
- 作为青年大学生如何肩负时代责任6篇 05-12
- 村党组织建设现状及工作亮点存在问题与 05-12
- 全面从严治党,自我革命重要论述研讨会 05-12
- 产业工人队伍建设改革(全文完整) 10-31
- 11-25国庆70周年庆典晚会 庆典晚会串词
- 11-25办公室礼仪的十大原则 浅谈办公室的电话礼仪
- 01-17用心灵轻轻地歌唱_心灵的歌唱
- 01-17也许你不是我一生的唯一|也许不是我
- 01-17爱了,请珍惜;不爱,趁早放手|爱就珍惜不爱就放手
- 01-17岁月带走的是记忆,但回忆会越来越清晰|有趣又有深意的句子
- 01-17曾经的美好只是曾经,我只想珍惜身边的人|我只想珍惜你
- 01-18从容不惊 [学会笑眼去看世界,不惊不乍,淡定从容]
- 02-03当代大学生学习态度调查报告
- 02-03常用护患英语会话
- 标签列表
