首页 > 心得体会 > 学习材料 / 正文
局部晚期直肠癌全程新辅助治疗的系统评价Δ
2023-05-11 11:50:46 ℃赵鹏飞,满新贺,赵 宏,黄永杰,贾甲旭,曹邦伟(.首都医科大学附属北京友谊医院放疗科,北京 00050;
.清华大学附属垂杨柳医院血管外科,北京 000;
3.首都医科大学附属北京友谊医院肿瘤科,北京 00050)
流行病学数据显示,2016年我国结直肠癌发病率和死亡率较往年均有一定的升高趋势[1]。目前,新辅助放化疗后行全系膜直肠切除术是局部晚期直肠癌的标准治疗方法。虽然这种综合治疗可以明显降低直肠癌术后5年局部复发率(低至5%~9%),但是远处转移率的控制仍不理想,5年远处转移率高达25%~35%。局部晚期直肠癌新辅助放化疗后是否行辅助化疗仍存在争议,目前大多数Ⅲ期随机对照研究结果证实,辅助化疗并未延长无病生存期(DFS)[2-4]。因此,探索新的治疗方案以改善直肠癌患者预后是临床亟待解决的问题。近年来,为尽早治疗亚临床微小转移灶,全程新辅助治疗(total neoadjuvant therapy,TNT)的模式应运而生。TNT模式包括新辅助放化疗前进行诱导化疗或新辅助放化疗后进行巩固化疗2种方式,即将原存在争议的辅助化疗提至手术前进行。目前,已有多项研究探讨了TNT模式用于直肠癌的疗效及安全性,但研究结论间存在矛盾。因此,本研究纳入最新研究,对TNT模式用于局部晚期直肠癌的疗效及安全性进行更新的Meta分析,以期为局部晚期直肠癌治疗决策提供新的思路及临床证据。
1.1 纳入与排除标准
1.1.1 研究类型:Ⅱ或Ⅲ期随机对照试验(RCT),且具备临床试验注册号,并正式发表。
1.1.2 研究对象:Ⅱ—Ⅲ期局部晚期直肠癌患者。
1.1.3 干预措施:TNT对比标准新辅助放化疗治疗局部晚期直肠癌。
1.1.4 结局指标:病理学完全缓解(pCR)、DFS、总生存期(OS)、3—4级不良反应和手术并发症。
1.1.5 排除标准:研究对象为晚期直肠癌患者;
非RCT研究或无临床试验注册号;
两组治疗方案均为TNT模式;
仅为会议发言或以摘要形式发表初步数据。
1.2 检索策略
本次Meta分析根据“Systematic Reviews and Meta-Analyses”(PRISMA)声明条目进行汇报[5],在PubMed、Embase、the Cochrane Library等英文数据库和中国知网、万方数据库中系统性搜索直肠癌全程新辅助治疗的临床研究,时间截至2022年7月。对相关文献的参考文献也进行检索,以确保所有文献均纳入分析。搜索文献的中文关键词包括“直肠癌”“新辅助放化疗”“全程新辅助治疗”“TNT”“RCT”和“随机对照试验”,英文关键词包括“Rectal cancer OR Rectal neoplasms OR Rectal carcinoma” AND “Total neoadjuvant therapy OR TNT OR Neoadjuvant chemoradiotherapy OR Concurrent chemoradiotherapy” AND “RCT OR Randomized controlled trial”。
1.3 纳入文献的资料提取与质量评价
由2名研究者对纳入的文献阅读全文并提取数据,若对数据提取存在分歧,则与第3名研究者讨论直到意见达成一致。提取入组研究的基本临床特征包括作者、临床研究名称、临床试验期别,随访时间,TNT组及标准治疗组具体治疗方案、临床基本资料,主要疗效及预后结局指标。应用Cochrane偏倚风险工具[6-7]对文献质量进行方法学评估,通过“高风险”“未知风险”及“低风险”3个标准进行评估描述,应用RevMan 5.3软件制作偏倚风险图和偏倚风险汇总图。
1.4 统计学方法
采用Stata 14.0软件进行Meta分析数据统计。生存结局治疗提取危险比(HR)及95%CI为效应量进行分析,二分类变量资料选用风险比(RR)及95%CI进行分析。数据资料异质性通过I2检验统计,若I2>50%且P<0.05,说明数据资料存在异质性,Meta分析应用随机效应模型;
否则,选取固定效应模型。RR>1说明TNT组较标准治疗组具有更高的pCR率、3—4级不良事件发生率及手术并发症发生率。发表偏倚通过Begg’s和Egger’s检测评估。
2.1 文献资料
通过数据库搜索,共检索出4 420篇文献;
阅读题目和摘要后,剔除重复文献、与研究内容不相关的文献、综述类、病例报道及基础实验文献后入组42篇文章;
阅读全文后,32篇文献由于不属于RCT研究、不存在目标结局等内容被剔除,最终共纳入10项临床RCT研究(涉及11篇文献[8-18])。纳入10项研究均进行了TNT模式与新辅助放化疗后手术的标准治疗进行对比,包括2 980例患者(TNT组1 504例患者,标准治疗组1 476例患者)。纳入研究的基本临床特征见表1。
2.2 纳入文献的质量评价
纳入文献的质量评价见图1。纳入文献均为RCT研究,结果显示均为高质量研究。

A.偏倚风险图;
B.偏倚风险汇总图A. diagram of risk of bias; B. summary diagram of risk of bias图1 纳入文献的质量评价Fig 1 Quality evaluation on enrolled literature
2.3 Meta分析结果
2.3.1 临床有效率:(1)TNT对比标准治疗对pCR率的影响。10篇文献[8,10-18]报告了pCR情况,TNT组患者的pCR率为21.1%(302/1 429),标准治疗组为12.2%(172/1 413);
Meta分析结果显示,TNT组患者的pCR率高于标准治疗组,差异有统计学意义(RR=1.73,95%CI=1.45~2.06,P<0.05),见图2。根据临床试验分期进行亚组分析,结果显示,Ⅲ期临床试验中TNT组患者的pCR率较标准治疗组更高,差异有统计学意义(RR=1.79,95%CI=1.49~2.16,P<0.05),而Ⅱ期临床试验中两组患者pCR率的差异无统计学意义(RR=1.41,95%CI=0.92~2.15,P>0.05),见图3。

图2 TNT组与标准治疗组患者pCR率比较的Meta分析森林图Fig 2 Meta-analysis of comparison of pCR rates between TNT group and standard treatment group

图3 Ⅱ期及Ⅲ期临床试验中TNT组与标准治疗组患者pCR率比较的Meta分析森林图Fig 3 Meta-analysis of comparison of pCR rates between TNT group and standard treatment group in phase Ⅱ and Ⅲ clinical trials
(2)TNT对比标准治疗对DFS、OS的影响。4篇文献[8,12,16-17]报告了DFS(中位随访时间见表1),Meta分析结果显示,TNT组患者的DFS长于标准治疗组,差异有统计学意义(HR=0.81,95%CI=0.70~0.95,P<0.05),见图4。5篇文献[8,12,16-18]报告了OS,Meta分析结果显示,TNT组患者的OS长于标准治疗组,差异有统计学意义(HR=0.78,95%CI=0.65~0.93,P<0.05),见图5。

图4 TNT组与标准治疗组患者DFS比较的Meta分析森林图Fig 4 Meta-analysis of comparison of DFS between TNT group and standard treatment group
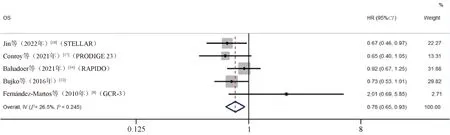
图5 TNT组与标准治疗组患者OS比较的Meta分析森林图Fig 5 Meta-analysis of comparison of OS between TNT group and standard treatment group
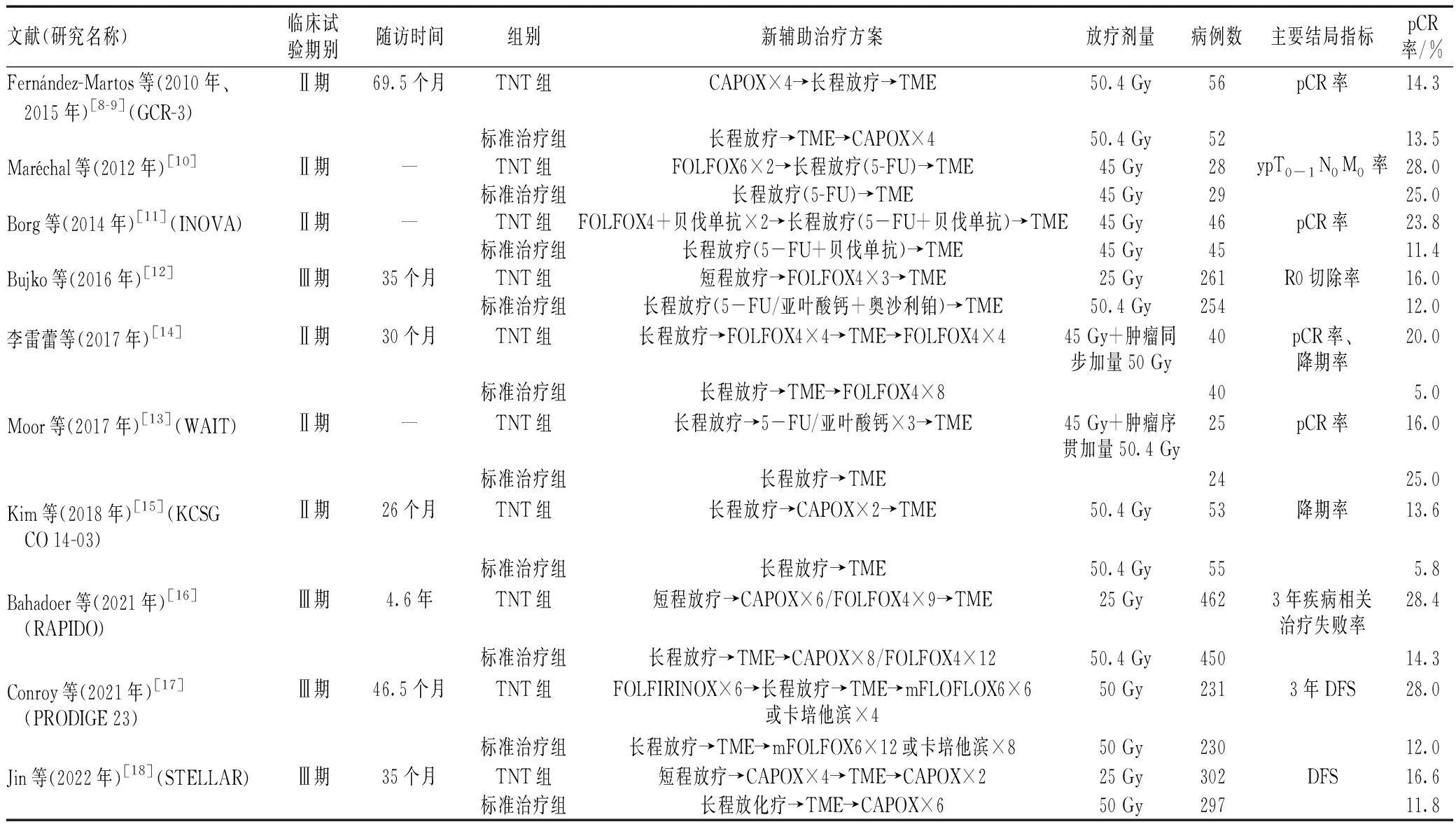
表1 纳入研究的基本临床特征Tab 1 Basic clinical characteristics of enrolled studies
(3)TNT中短程放疗(short-course radiotherapy,SCRT)或长程放疗(long-course radiotherapy,LCRT)以及TNT中巩固化疗或诱导化疗对比标准治疗对pCR率的影响。Meta分析结果显示,TNT组患者放疗采用SCRT或LCRT的pCR率较标准治疗组高,差异均有统计学意义(SCRT:RR=1.68,95%CI=1.36~2.07,P<0.05;
LCRT:RR=1.82,95%CI=1.36~2.45,P<0.05),见图6;
TNT组患者化疗采用巩固化疗或诱导化疗的pCR率较标准治疗组高,差异均有统计学意义(巩固化疗:RR=1.68,95%CI=1.37~2.05,P<0.05;
诱导化疗:RR=1.85,95%CI=1.34~2.57,P<0.05),见图7。
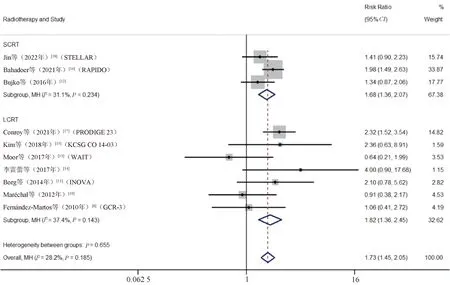
图6 TNT组采用SCRT或LCRT的患者与标准治疗组患者pCR率比较的Meta分析森林图Fig 6 Meta-analysis of comparison of pCR rates between patients in standard treatment group and patients adopted SCRT or LCRT in TNT group

图7 TNT组采用巩固化疗或诱导化疗的患者与标准治疗组患者pCR率比较的Meta分析森林图Fig 7 Meta-analysis of comparison of pCR rates between patients in standard treatment group and patients receiving consolidate chemotherapy or inducing chemotherapy in TNT group
2.3.2 放化疗期间3—4级不良反应及手术并发症:Meta分析结果显示,TNT组与标准治疗组患者3—4级不良反应发生率的差异无统计学意义(RR=1.27,95%CI=0.93~1.75,P>0.05),见图8;
TNT组与标准治疗组患者手术并发症发生率的差异无统计学意义(RR=1.00,95%CI=0.88~1.14,P>0.05),见图9。

图8 TNT组与标准治疗组患者放化疗期间3—4级不良事件发生率比较的Meta分析森林图Fig 8 Meta-analysis of comparison of incidences of grade 3-4 adverse events between TNT group and standard treatment group during radiochemotherpy

图9 TNT组与标准治疗组患者手术并发症发生率比较的Meta分析森林图Fig 9 Meta-analysis of comparison of incidences of surgical complications between TNT group and standard treatment group
2.4 发表偏倚
对于两组患者pCR率进行发表偏倚分析,Egger’s检测的P值为0.183,Begg’s检测的P值为0.386,提示两组患者的pCR率不存在发表偏倚。进一步的漏斗图分析发现,基线两侧基本对称,亦提示不存在发表偏倚。
目前,局部晚期直肠癌相关指南已推荐TNT模式可用于Ⅱ/Ⅲ期直肠癌患者,但其中仍存在一些问题。虽然既往有研究对相关内容进行了Meta分析,但其入组包含多个回顾性研究及队列研究[19-21]。而本研究仅纳入具有临床试验注册号的RCT研究,且汇总了最新发表的临床试验数据,更新的Meta分析结果显示,与标准治疗比较,TNT可提高局部晚期直肠癌患者的pCR率,延长DFS及OS,且不增加3—4级不良事件及手术并发症的发生。
短期疗效指标pCR率作为局部晚期直肠癌相关研究的首要或次要研究指标,其通常与更好的远期预后相关[22]。本研究结果显示,pCR率更高的TNT组患者有DFS及OS获益,与既往研究结果一致[23]。进一步分析结果显示,TNT组患者具有的短期疗效和生存获益并不是以增加手术并发症和放化疗不良反应为代价。
局部晚期直肠癌术前行SCRT后序贯TME手术是指南推荐的另一种方案,多项RCT研究结果显示,术前SCRT与LCRT疗效相当,两者的OS、DFS及局部控制率无差别,且不良反应和手术并发症的发生率相近。CAO/ARO/AIO-12的Ⅱ期研究结果显示,放化疗后巩固化疗对比诱导化疗后放化疗具有更高的pCR率(25%vs. 17%)[24]。本研究中,巩固化疗组、诱导化疗组患者的pCR率分别为19%、23.5%,均显著高于标准组。然而,TNT模式中巩固化疗及诱导化疗之间是否真正存在远期生存预后差异仍然需要进一步随访,根据目前的研究,2种TNT治疗方式均可考虑。
但是,本次Meta分析结果显示,与标准治疗组比较,Ⅱ期临床试验中TNT组患者的pCR率无获益,而Ⅲ期临床试验中TNT组患者的pCR率获益具有统计学意义,不可否认的是,大样本Ⅲ期RCT且具有长期生存结局的临床试验结果更具参考价值。此外,本次Meta分析中仍有一些问题值得关注:(1)TNT模式下诱导化疗及巩固化疗方案、剂量、周期数选择各不相同。例如,PRODIGE 23研究[17]选择更强的FOLFIRINOX三药方案;
而其他研究选择CAPOX、FOLFOX4、5-FU/亚叶酸钙、FOLFOX4+贝伐单抗和改良FOLFOX6方案。(2)辅助化疗与否以及方案、剂量、持续时间亦存在明显差异。例如,STELLAR研究[18]选择CAPOX辅助化疗;
PRODIGE 23研究[17]中为mFOLFOX6或卡培他滨辅助化疗;
李雷蕾等[14]的研究中为FOLFOX4辅助化疗;
其余研究中TNT组无辅助治疗。(3)入组人群基本临床特征不一,如T分期、N分期、肠壁外血管受侵和直肠系膜筋膜受侵情况等。(4)各研究的主要结局指标也不相同,研究设计中不同的结局指标也是一种偏倚因素。
总之,TNT治疗局部晚期直肠癌是一种新的治疗方式,虽然目前Meta分析入组研究存在一定的不均质性,最佳的放化疗顺序及化疗方案需要进一步探讨明确,但TNT模式仍具有较好的短期疗效和安全性,值得临床进一步应用及推广。
猜你喜欢临床试验放化疗直肠癌抗疫中第一个获批临床试验的中药——说说化湿败毒方基层中医药(2020年5期)2020-09-11腹腔镜下直肠癌前侧切除术治疗直肠癌的效果观察中国医药指南(2017年3期)2017-11-13直肠癌新辅助放化疗后,“等等再看”能否成为主流?临床误诊误治(2017年2期)2017-03-14直肠癌术前放疗的研究进展西南军医(2016年3期)2016-01-23COXⅠ和COX Ⅲ在结直肠癌组织中的表达及其临床意义中国继续医学教育(2015年6期)2016-01-07GRP及GRPR在结直肠癌中的表达及意义中国当代医药(2015年30期)2015-03-01高危宫颈癌术后同步放化疗与单纯放疗的随机对照研究中国当代医药(2015年17期)2015-03-01肝内胆管癌行全身放化疗后缓解一例肝胆胰外科杂志(2015年5期)2015-02-27晚期NSCLC同步放化疗和EGFR-TKI治疗的临床研究进展西南军医(2014年5期)2014-04-25肿瘤治疗药物Tosedostat的Ⅱ期临床试验结束中国合理用药探索(2012年2期)2012-03-20猜你喜欢
- 2024-01-20 有关于第五次全国经济普查统计重点业务综合培训大会上讲话(完整文档)
- 2024-01-20 “严纪律、转作风、保安全、树形象”专题学习教育活动通知(完整文档)
- 2024-01-20 2024XX区住房城乡建设工作情况汇报
- 2024-01-20 2024高校思政教育交流材料:善用反腐败斗争这堂“大思政课”(精选文档)
- 2024-01-20 2024年主题教育专题党课辅导报告,(4)
- 2024-01-20 关于赴某地学习考察地方立法工作情况报告(范文推荐)
- 2024-01-20 2024年度关于增强党建带团建工作实效对策与建议(精选文档)
- 2024-01-20 教师演讲稿:春风化雨育桃李,,潜心耕耘满芬芳(全文)
- 2024-01-20 主题教育第二阶段来了
- 2024-01-20 2024年度关于到信访局实践锻炼个人总结【完整版】
- 搜索
-
- 打赌输了任人处理作文1000字7篇 05-12
- 当代大学生在全面建设社会主义现代化强 05-12
- 全面建成社会主义现代化强国的战略安排 03-10
- 个人廉洁自律方面存在的问题及整改措施 05-12
- 谈谈青年大学生在中国式现代化征程上的 05-12
- 2022年党支部第一议题会议记录(全文完 11-02
- 作为青年大学生如何肩负时代责任6篇 05-12
- 村党组织建设现状及工作亮点存在问题与 05-12
- 全面从严治党,自我革命重要论述研讨会 05-12
- 产业工人队伍建设改革(全文完整) 10-31
- 11-25国庆70周年庆典晚会 庆典晚会串词
- 11-25办公室礼仪的十大原则 浅谈办公室的电话礼仪
- 01-17用心灵轻轻地歌唱_心灵的歌唱
- 01-17也许你不是我一生的唯一|也许不是我
- 01-17爱了,请珍惜;不爱,趁早放手|爱就珍惜不爱就放手
- 01-17岁月带走的是记忆,但回忆会越来越清晰|有趣又有深意的句子
- 01-17曾经的美好只是曾经,我只想珍惜身边的人|我只想珍惜你
- 01-18从容不惊 [学会笑眼去看世界,不惊不乍,淡定从容]
- 02-03当代大学生学习态度调查报告
- 02-03常用护患英语会话
- 标签列表
