首页 > 心得体会 > 学习材料 / 正文
无针免疫猪圆环病毒2型亚单位疫苗效果评价
2023-05-11 20:45:03 ℃张光际,蔡 伟,胡佳伟,崔超越,吴莲玉,魏旭峰,4
(1.泰州职业技术学院医学院,江苏泰州 225300;
2.江苏美凤力医疗科技有限公司,江苏泰州 225300;
3.江苏铂可医疗科技有限公司,江苏泰州 225300;
4.无锡明慈心血管病医院,江苏无锡 214000)
猪圆环病毒病(porcine circovirus disease,PCVD)是一种广泛流行的猪传染性疾病,由猪圆环病毒2型(porcine circovirus type 2,PCV-2)感染引起[1-3]。断奶仔猪对本病最易感,临床表现为多系统衰竭综合征(postweaning multysystemic wasting syndrome,PMWS)、猪皮炎-肾病综合征、繁殖障碍、肺炎、肠炎、先天性震颤等诸多疾病,对养猪业造成了巨大经济损失。目前PCV-2感染尚无有效治疗措施,且病毒抵抗力强,猪场净化难度高,因此疫苗接种是当前最有效的防控手段之一[4]。针对不同日龄的仔猪可以选择灭活疫苗或亚单位疫苗,各种商业化疫苗己在世界各地养殖场广泛应用,但目前常用的有针注射方式存在针刺痛感明显、注射耗时、操作不便等缺点[5-6]。无针注射器与皮肤碰撞后使皮肤外层的角质层发生振荡,产生肉眼看不见的小空隙,通过动力源推动活塞作用于药室,快速形成压力,使药物通过喷嘴的速度可达100~200 m/s,药液以一股极细的射流穿透皮肤,当射流在皮肤内受阻其速度衰减到一定程度时开始呈多向分散,均匀分布在皮下或皮内,整个过程在100 μs内快速完成[7-9]。无针注射用于疫苗接种具有注射效率高、避免交叉感染、抗原分散高和动物疼痛感低等优点。但有报道[10]称,对山羊进行无针免疫保护率维持时间短,免疫效果不确定,其在兽医领域应用有待进一步观察。无针注射临床人用以治疗糖尿病给药多见,而针对仔猪进行无针免疫的评价则较少[11]。本试验分别采用有针注射器和无针注射器为仔猪接种PCV-2亚单位疫苗,观察仔猪注射后的临床表现并评估免疫效果,以期为采用无针注射器接种疫苗提供相关数据支撑。
1.1 试验动物
40头3~5周龄三元猪(PCV-2抗原/抗体检测均为阴性,无其他免疫抑制性疾病病原,个体均匀),由泰州泰和生物科技有限公司提供。
1.2 主要试验材料
PCV-2亚单位疫苗(Ingelvac CircoFLEX,批号3091476B),由勃林格殷翰动物保健(美国)有限公司提供;
PCV-2抗体ELISA检测试剂盒(批号20220507),购自韩国金诺(MEDIAN)诊断试剂株式会社;
POK-V-MBX兽用无针注射器,由江苏铂可医疗科技有限公司提供;
传统有针注射器,购自江苏科伦医疗器械制造有限公司;
MR-96A酶标仪,购自深圳迈瑞生物医疗电子股份有限公司。
1.3 试验分组及指标
选择3~5周龄PCV-2抗原/抗体阴性、无其他免疫抑制性疾病病原、个体均匀的三元猪仔猪40头,随机分成4组(10头/组),分别为有针组(耳后肌肉注射1.00 mL,1头份)、无针免疫低(耳后接种0.25 mL,1/4头份)、中(耳后接种0.50 mL,1/2头份)、高(耳后接种1.00 mL,1头份)剂量组。分别于分组后第1天和第21天分2次免疫对应剂量的PCV-2亚单位疫苗,并于首次接种后7、14、21、28、42 d采血,静置30 min后3 000 r/min离心10 min,取上清待检。
按照PCV-2抗体ELISA试剂盒说明书测定抗体效价,在630 nm处通过酶标仪测定各孔吸光度。S/P≥0.4,判定PCV-2抗体阳性,S/P<0.4,判定PCV-2抗体阴性。比较不同剂量、方法接种疫苗后抗体产生情况。首次免疫后对所有试验动物连续观察42 d,观察指标包括:临床症状(精神、采食、饮水、行为)、首次免疫后42 d接种局部的大体观察、试验动物始末体质量。
1.4 统计学方法
采用SPSS 25.0软件对计量资料进行统计分析,以单因素方差分析法对各组数据进行差异显著性分析,结果以“平均数±标准误()”表示,P<0.05表示差异显著,P>0.05表示差异不显著。
2.1 不同免疫方法对动物临床表现的影响
各组动物经不同注射方式免疫后有不同程度的疼痛表现,伴随免疫后短时的吼叫、自主行为增加。有针注射组注射时挣扎时间较长,痛感明显;
无针免疫低、中、高剂量组动物疼痛表现有一定的剂量依赖性,随注射次数增加,注射时吼叫加重,单次接种时疼痛表现较轻,表现为一过性疼痛,注射后表现良好。各组动物经不同方式注射后的精神状态、进食状况、饮水状况、自发行为、注射部位等均未见异常。
2.2 不同免疫方法对动物体质量的影响
试验开始前各组动物体质量均匀,组间体质量未见差异(P>0.05),分组具有可比性。试验结束后各组动物体质量未见差异(P>0.05)。与有针注射组动物比较,无针免疫低剂量组试验动物在试验周期内增加的体质量和平均日增重显著增加(P<0.05),其余各组动物体质量未见差异(P>0.05)。结果表明小剂量无针免疫的方式可以促进仔猪生长,免疫次数增加则增重效果消失。具体结果见表1。
表1 试验周期内各组动物体质量变化(,n=10)
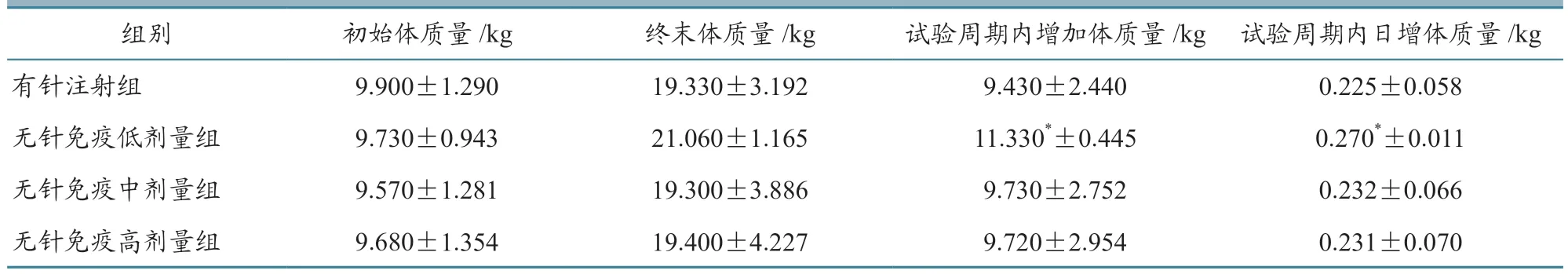
表1 试验周期内各组动物体质量变化(,n=10)
注:*表示与有针注射组比较,差异显著(P<0.05)。
2.3 不同免疫方法对动物抗体阳性率的影响
各组动物免疫后PCV-2抗体均有不同程度表达。首次免疫后各组动物体内抗体均可在第2周达到100%阳性。有针注射1头份亚单位疫苗免疫后第3周阳性率有所下降,为80%,经过第2次免疫,可有效升至100%,保护效果较佳。无针免疫1/4头份亚单位疫苗组动物体内抗体第1周即可达到80%阳性率,随后升至100%,二次免疫后可有效维持100%抗体阳性率。无针免疫1/2头份亚单位疫苗组动物体内抗体第1周即可达到90%阳性率,随后维持100%阳性。无针免疫1头份亚单位疫苗组动物体内抗体第1周阳性率50%,第2周其可迅速提高阳性率至100%,并维持到试验结束。具体结果见图1。

图1 不同免疫方法对动物抗体阳性率的影响
2.4 不同免疫方法对动物体内抗体水平的影响
以不同方式进行PCV-2亚单位疫苗免疫后,各组动物体内抗体水平均呈现不同程度的升高,二次免疫后抗体升高更显著。与有针注射组动物比较,无针免疫组1头份亚单位疫苗单次免疫1周后抗体水平较低(P<0.05),第2周抗体水平显著升高,二次免疫后抗体水平显著高于有针注射组(P<0.05),随后极显著高于有针注射组(P<0.01);
无针免疫低、中剂量组动物体内抗体水平未见差异(P>0.05),免疫后各阶段抗体水平与有针注射组相当(P>0.05)。与无针免疫低剂量组动物比较,中剂量组动物免疫后体内抗体水平未见差异(P>0.05),高剂量组动物二次免疫后体内抗体水平较高(P<0.05,P<0.01)。与无针免疫中剂量组动物比较,高剂量组动物二次免疫后体内抗体水平均较高(P<0.05,P<0.01)。具体结果见表2。
表2 不同免疫方法对动物体内抗体水平S/P的影响(,n=10)
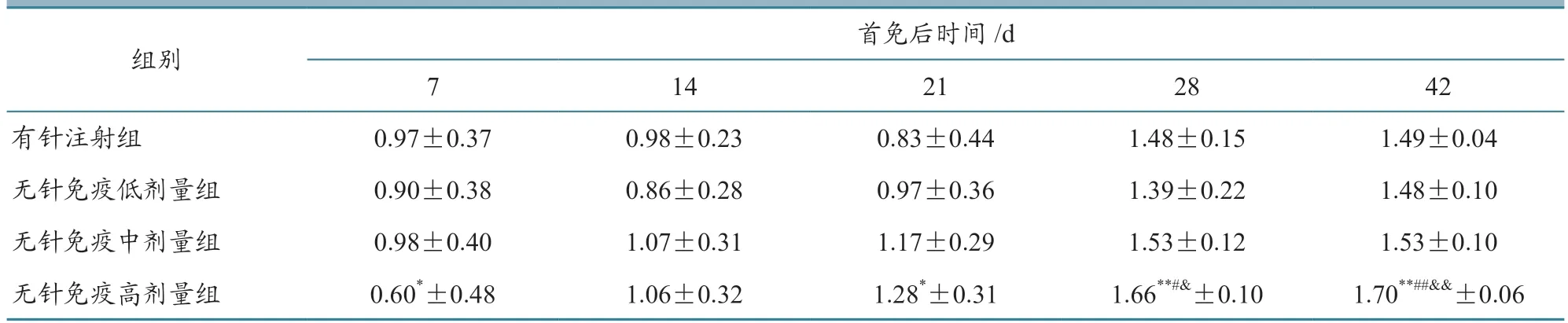
表2 不同免疫方法对动物体内抗体水平S/P的影响(,n=10)
注:与有针注射组比较,*表示差异显著(P<0.05),** 表示差异极显著(P<0.01);
与无针免疫低剂量组比较,#表示差异显著(P<0.05),##表示差异极显著(P<0.01);
与无针免疫中剂量组比较,&表示差异显著(P<0.05),&&表示差异极显著(P<0.01)。
动物疫病免疫是指使动物淋巴细胞通过对疫苗的识别、活化、增殖、分化,最后产生免疫效应分子(抗体和细胞因子)及免疫效应细胞,从而使动物机体获得对特定病原微生物的特异抵抗能力。该特异抵抗能力可以增强动物抗病力,从而达到预防某种动物疫病的目的。目前动物疫病免疫的主要方法有滴眼、滴鼻、注射及口服免疫等方式。其中,注射免疫具有应用广、可靠性高、经济有效等优点,是动物疫病预防的重要手段[12]。注射免疫过程中需要注意注射器械的灭菌与注射部位的消毒,根据疫苗接种需要,合理选择不同规格的针头。针头不能太短,避免因针头短导致疫苗注射在皮下,也不能太长,针头太长在接种完疫苗抽出时容易造成疫苗溢出,特别是皮下注射[13-14]。因此现行的注射免疫方法存在一定短板。
无针接种疫苗具有可简化给药过程、提高接种人员的职业安全性、消除注射位点疼痛、减少接种成本以及获得更好的免疫原性等优势。无针注射可以在100 μs内将疫苗快速、均匀接种到皮下或皮内[15]。皮肤由表皮、真皮和皮下组织(脂肪层)组成,是外伤和感染的第一道物理和免疫屏障,比肌肉具有更强的免疫原性。真皮层内有高浓度的树突状细胞(dendritic cell,DC),通过捕获和呈递抗原来诱导和调节天然免疫反应。此外,真皮层还有丰富的淋巴和血管。皮内接种后,DC吞噬抗原被激活,这些活化的细胞迁移到淋巴结,从而依次激活B淋巴细胞。疫苗诱导的局部炎症反应可吸引炎性细胞,这些细胞可分化为DC和巨噬细胞,参与免疫应答。因此,无针皮内免疫反应过程可能比有针肌肉注射疫苗免疫反应更快、更安全有效[16-17]。与有针注射相比,无针注射产生的免疫应答情况持平或更强,能够诱导更高水平的抗体滴度和血清抗体转换率。同时,相比有针注射器注射疫苗后在组织中形成球形液体,无针注射器注射的疫苗形成的高压射流,在组织中分散较好,无针注射技术在大规模免疫接种领域可以发挥更大作用[18-19]。
本试验无针免疫后动物的耐受、自发活动、精神状态、饮食饮水等均未见异常。与有针注射组动物比较,无针注射低剂量组动物试验期间体质量增加量和日均增重量均有所提高,反映出无针免疫相对有针注射造成的免疫应激更小,无针注射的免疫方式更加安全可靠,减量免疫即可达到同等免疫效果,可以缩短免疫时间,便捷操作,同时可以节约免疫成本,有效促进仔猪生长。
本试验表明,两种免疫方式均可达到理想免疫效果。4组试验动物经2次免疫后体内抗体阳性率均达到100%,且均可以有效维持到试验结束。无针免疫低、中剂量组动物体内抗体响应速度及二次免疫后保护效果与有针注射组动物无差异。有针组通过耳后肌肉注射,以球形液滴的形式存在于耳后肌肉组织,分散度欠佳,单次免疫第3周抗体阳性率降为80%,单次免疫抗体维持时间较短,造成一定阶段的风险暴露;
无针免疫通过高压射流使疫苗迅速均匀接种到耳后皮下或皮内,迅速激活DC、B淋巴细胞,诱导更高的抗体滴度应答和血清抗体转换率,并可以有效维持整个周期的有效免疫。无针免疫高剂量组动物体内抗体产生减慢,推测原因可能是由于多次免疫刺激,短时间4次重复免疫0.25 mL亚单位疫苗导致短时高速喷射入动物皮下和皮内的疫苗聚集,抗原剂量非最适免疫剂量,随着吸收时间延长及2次免疫迅速激活抗原识别后,无针注射产生疫苗分散度较高的优势得以体现,同等剂量的疫苗经有针和无针两种方式进行2次免疫后,无针注射的动物体内抗体浓度更高。
综上所述,采用无针注射器进行PCV-2亚单位疫苗接种安全、有效,降低免疫剂量仍可达到理想的免疫效果,且可以促进仔猪生长,实现全周期保护。综合无针注射的免疫方式耗时短、避免交叉感染等特点,可以推广为养猪业相关疫苗接种的有效方式。试验中每组10头猪的数量相对较少,在后续研究中课题组将进一步扩大受试动物数量和研究内容,更全面地评估无针免疫效果。
猜你喜欢无针头份阳性率打针也温柔知识就是力量(2021年11期)2021-11-05秋季要注射疫苗防猪患乙脑河南畜牧兽医(2020年17期)2020-01-10胰岛素注射,无针与有针该咋选江苏卫生保健(2018年9期)2018-02-13无针注射器在胰岛素注射中的应用研究进展护理研究(2017年6期)2017-02-28不同类型标本不同时间微生物检验结果阳性率分析中外医疗(2016年15期)2016-12-01无针注射器小学科学(2015年9期)2015-09-28密切接触者PPD强阳性率在学校结核病暴发风险评估中的应用价值结核与肺部疾病杂志(2015年1期)2015-07-18肌电图在肘管综合征中的诊断阳性率与鉴别诊断现代电生理学杂志(2015年1期)2015-07-18欧美的猫弓形虫感染情况及影响因素研究进展*寄生虫与医学昆虫学报(2013年2期)2013-02-19猜你喜欢
- 2024-01-20 有关于第五次全国经济普查统计重点业务综合培训大会上讲话(完整文档)
- 2024-01-20 “严纪律、转作风、保安全、树形象”专题学习教育活动通知(完整文档)
- 2024-01-20 2024XX区住房城乡建设工作情况汇报
- 2024-01-20 2024高校思政教育交流材料:善用反腐败斗争这堂“大思政课”(精选文档)
- 2024-01-20 2024年主题教育专题党课辅导报告,(4)
- 2024-01-20 关于赴某地学习考察地方立法工作情况报告(范文推荐)
- 2024-01-20 2024年度关于增强党建带团建工作实效对策与建议(精选文档)
- 2024-01-20 教师演讲稿:春风化雨育桃李,,潜心耕耘满芬芳(全文)
- 2024-01-20 主题教育第二阶段来了
- 2024-01-20 2024年度关于到信访局实践锻炼个人总结【完整版】
- 搜索
-
- 打赌输了任人处理作文1000字7篇 05-12
- 当代大学生在全面建设社会主义现代化强 05-12
- 全面建成社会主义现代化强国的战略安排 03-10
- 个人廉洁自律方面存在的问题及整改措施 05-12
- 谈谈青年大学生在中国式现代化征程上的 05-12
- 2022年党支部第一议题会议记录(全文完 11-02
- 作为青年大学生如何肩负时代责任6篇 05-12
- 村党组织建设现状及工作亮点存在问题与 05-12
- 全面从严治党,自我革命重要论述研讨会 05-12
- 产业工人队伍建设改革(全文完整) 10-31
- 11-25国庆70周年庆典晚会 庆典晚会串词
- 11-25办公室礼仪的十大原则 浅谈办公室的电话礼仪
- 01-17用心灵轻轻地歌唱_心灵的歌唱
- 01-17也许你不是我一生的唯一|也许不是我
- 01-17爱了,请珍惜;不爱,趁早放手|爱就珍惜不爱就放手
- 01-17岁月带走的是记忆,但回忆会越来越清晰|有趣又有深意的句子
- 01-17曾经的美好只是曾经,我只想珍惜身边的人|我只想珍惜你
- 01-18从容不惊 [学会笑眼去看世界,不惊不乍,淡定从容]
- 02-03当代大学生学习态度调查报告
- 02-03常用护患英语会话
- 标签列表
